题目内容
【题目】CaS在环境保护、制备电致发光材料等方面用途非常广泛。回答下列问题:
(1)制取CaS的反应如下:
反应(I):CaSO4(s)+2C(s)![]() CaS(s)+2CO2(g) △H1
CaS(s)+2CO2(g) △H1
反应(II):CaCO3(s)+H2S(g)![]() CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
①若在恒温恒容密闭容器中只发生反应(I),达到平衡时向容器中通入少量CO2,则反应再次达到平衡时c(CO2)将___(填“增大”“减小”或“不变”)。
②已知下列热化学方程式:.
i:S2(g)+CaSO4(s)![]() CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
ii:2SO2(g)+4CO(g)=S2(g)+4CO2(g) △H=+16.0kJ·mol-1
iii:C(s)+CO2(g)=2CO(g) △H=+172.5kJ·mol-1
则反应(I)的△H1=___kJ·mol-1。
③反应(II)的△S___(填“>”“<”或“=”)0。若反应(II)在恒温恒容密闭容器中进行,能说明该反应已达到平衡状态的是___(填字母)。
A.v(H2O)正=v(CO2)正
B.容器中气体总压强不再随时间变化
C.容器中同时存在H2S(g)、CO2(g)和H2O(g)
D.单位时间内断裂H-S键与断裂C=O键数目相等
(2)CaS能被许多物质氧化,有关反应的lgKp与温度关系如图(Kp为以分压表示的平衡常数;分压=总压×物质的量分数;图中数据由压强单位为kPa得出)。
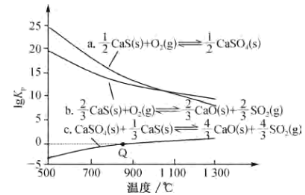
①属于吸热反应的是___ (填“a”“b”或“c”)。
②相同温度下,反应a、b、c的lgKp(a)、lgKp(b)、lgKp(c)之间满足的关系是lgKp(c)=___。
③反应c在Q点时:p(SO2)=___kPa,以浓度表示的平衡常数Kc=___Kp[用R、T表示;已知气体的压强、体积、温度满足pV=nRT(n为气体的物质的量,R为恒量)]。
【答案】不变 +601.4 > BD c 2lgKp(b)-2lgKp(a) 1 (RT)![]()
【解析】
(1)①若在恒温恒容密闭容器中只发生反应(I),平衡常数K=c2(CO2),温度不变平衡常数不变;
②根据盖斯定律计算解答;
③反应(II) CaCO3(s)+H2S(g)![]() CaS(s)+H2O(g)+CO2(g)为气体体积增大的反应;
CaS(s)+H2O(g)+CO2(g)为气体体积增大的反应;
A.v(H2O)正=v(CO2)正都是正反应方向的速率;
B.在恒温恒容条件下,反应(II)为气体体积增大的反应;
C.不论反应是否到平衡,反应一开始,容器中同时存在H2S(g)、CO2(g)和H2O(g);
D.单位时间内断裂H-S键与断裂C=O键数目相等,说明正逆反应速率相等;
(2)①lgKp越小,平衡常数越小,根据图像,升高温度,lgK减小,平衡常数减小,据此分析解答;
②a:![]() CaS(s)+O2(g)
CaS(s)+O2(g)![]() CaSO4(s) Kp(a)
CaSO4(s) Kp(a)
b:![]() CaS(s)+O2(g)
CaS(s)+O2(g)![]() CaO(s)+
CaO(s)+![]() SO2(g) Kp(b)
SO2(g) Kp(b)
c:CaSO4(s)+![]() CaS(s)
CaS(s) ![]() CaO(s)+
CaO(s)+![]() SO2(g) Kp(c)
SO2(g) Kp(c)
根据盖斯定律c=2(b-a)可得,Kp(c)=(![]() )2;
)2;
③反应c:CaSO4(s)+![]() CaS(s)
CaS(s) ![]() CaO(s)+
CaO(s)+![]() SO2(g)在Q点时,lgKp(c)=0,Kp(c)=1;以浓度表示的平衡常数Kc=
SO2(g)在Q点时,lgKp(c)=0,Kp(c)=1;以浓度表示的平衡常数Kc=![]() ,根据pV=nRT,
,根据pV=nRT,![]() =c,据此分析解答。
=c,据此分析解答。
(1)①若在恒温恒容密闭容器中只发生反应(I),平衡常数K=c2(CO2),温度不变平衡常数不变,则反应再次达到平衡时c(CO2)将不变;
②已知下列热化学方程式:.
i:S2(g)+CaSO4(s)![]() CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
ii:2SO2(g)+4CO(g)=S2(g)+4CO2(g) △H=+16.0kJ·mol-1
iii:C(s)+CO2(g)=2CO(g) △H=+172.5kJ·mol-1
根据盖斯定律,i+ii+iii ×2可得:CaSO4(s)+2C(s)![]() CaS(s)+2CO2(g) △H1=+601.4 kJ·mol-1;
CaS(s)+2CO2(g) △H1=+601.4 kJ·mol-1;
③反应(II) CaCO3(s)+H2S(g)![]() CaS(s)+H2O(g)+CO2(g)为气体体积增大的反应体系,体系的混乱度增大,则△S>0;
CaS(s)+H2O(g)+CO2(g)为气体体积增大的反应体系,体系的混乱度增大,则△S>0;
A.v(H2O)正=v(CO2)正都是正反应方向的速率,不能作为判断反应达到平衡的依据,故A不符合题意;
B.恒温恒容条件下,反应(II)为气体体积增大的反应体系,当容器中气体总压强不再随时间变化时,反应达到平衡状态,故B符合题意;
C.不论反应是否达到平衡状态,只要反应一开始,容器中就同时存在H2S(g)、CO2(g)和H2O(g),不能作为判断反应达到平衡状态的标志,故C不符合题意;
D.单位时间内断裂H-S键与断裂C=O键数目相等,即消耗1mol H2S的同时也消耗1mol的CO2,即正逆反应速率相等,可说明反应达到平衡状态,故D符合题意;
答案选BD。
(2)①根据图像,随温度升高反应a、b 的lgKp减小,平衡常数减小,说明反应逆向移动,则正反应为放热反应;随温度升高反应c的lgKp增大,平衡常数增大,说明反应正向移动,则正反应为吸热反应;
②a:![]() CaS(s)+O2(g)
CaS(s)+O2(g)![]() CaSO4(s) Kp(a)
CaSO4(s) Kp(a)
b:![]() CaS(s)+O2(g)
CaS(s)+O2(g)![]() CaO(s)+
CaO(s)+![]() SO2(g) Kp(b)
SO2(g) Kp(b)
c:CaSO4(s)+![]() CaS(s)
CaS(s) ![]() CaO(s)+
CaO(s)+![]() SO2(g) Kp(c)
SO2(g) Kp(c)
根据盖斯定律c=2(b-a)可得,Kp(c)=(![]() )2;
)2;
则lgKp(c)=2lg (![]() )=2lgKp(b)-2lgKp(a);
)=2lgKp(b)-2lgKp(a);
③反应c:CaSO4(s)+![]() CaS(s)
CaS(s) ![]() CaO(s)+
CaO(s)+![]() SO2(g)在Q点时,lgKp(c)=0,Kp(c)=1=
SO2(g)在Q点时,lgKp(c)=0,Kp(c)=1=![]() ,则p(SO2)=1kPa;以浓度表示该反应的平衡常数Kc=
,则p(SO2)=1kPa;以浓度表示该反应的平衡常数Kc=![]() ,根据pV=nRT,
,根据pV=nRT,![]() =c,则c(SO2)=
=c,则c(SO2)=![]() ,则Kc=
,则Kc=![]() =
=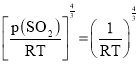 =(RT)
=(RT)![]() ,则
,则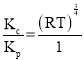 ,Kc=(RT)
,Kc=(RT)![]() Kp。
Kp。