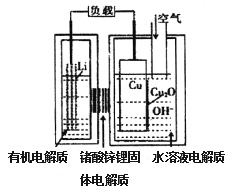
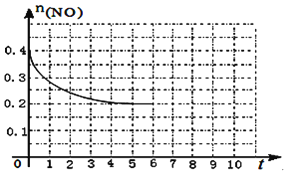
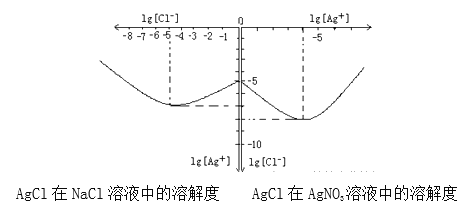
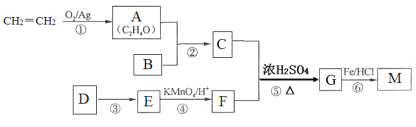
题目内容
【题目】氢气、铝、铁都是重要的还原剂,已知下列反应的热化学方程式,下列关于反应的焓变判断正确的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
【答案】B
【解析】试题分析:A、物质的燃烧均为放热反应,而放热反应的反应热均为负值,故A错误;B、铝热反应为放热反应,故△H5<0;而2Fe(s)+![]() O2(g)=Fe2O3(s)△H3 ③,2Al(s)+
O2(g)=Fe2O3(s)△H3 ③,2Al(s)+![]() O2(g)=Al2O3(s)△H4④,将④-③可得:2Al(s)+Fe2O3(s)=A12O3(s)+2Fe(s)△H5=△H4-△H3<0时,故△H4<△H3,故B正确;C、已知:3H2(g)+Fe2O3(s)=2Fe(s)+3H2O(g)△H2 ②、2Fe(s)+
O2(g)=Al2O3(s)△H4④,将④-③可得:2Al(s)+Fe2O3(s)=A12O3(s)+2Fe(s)△H5=△H4-△H3<0时,故△H4<△H3,故B正确;C、已知:3H2(g)+Fe2O3(s)=2Fe(s)+3H2O(g)△H2 ②、2Fe(s)+![]() O2(g)=Fe2O3(s)△H3③,将(②+③)×
O2(g)=Fe2O3(s)△H3③,将(②+③)×![]() 可得:2H2(g)+O2(g)=2H2O(g)△H1=
可得:2H2(g)+O2(g)=2H2O(g)△H1=![]() (△H2+△H3),故C错误;D、已知:2Fe(s)+
(△H2+△H3),故C错误;D、已知:2Fe(s)+![]() O2(g)=Fe2O3(s)△H3 ③,2Al(s)+
O2(g)=Fe2O3(s)△H3 ③,2Al(s)+![]() O2(g)=Al2O3(s)△H4④,将④-③可得:2Al(s)+Fe2O3(s)=A12O3(s)+2Fe(s) 故有:△H5=△H4-△H3,即:△H3=△H5-△H4,故D错误;故选B。
O2(g)=Al2O3(s)△H4④,将④-③可得:2Al(s)+Fe2O3(s)=A12O3(s)+2Fe(s) 故有:△H5=△H4-△H3,即:△H3=△H5-△H4,故D错误;故选B。

【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1, +7 | +3 | ||
其他 | 阳离子核 外无电子 | 无机非金属 材料的主角 | 焰色反 应呈黄色 |
(1) R在元素周期表中的位置是____;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为 __________________________________________
(2) 根据表中数据推测,Y的原子半径(用r表示)的最小范围是____________。
(3)Y与R相比,非金属性较强的是____(用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
A.常温下Y的单质呈固态,R的单质呈气态
B.稳定性XR>YX4
C.Y最高价氧化物对应水化物的酸性弱于R最高价氧化物对应水化物的酸性
(4)用电子式表示X2M___________。
(5) Z的单质与水反应的化学方程式是____________________________。
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(l)ClO2的制备:(已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4)
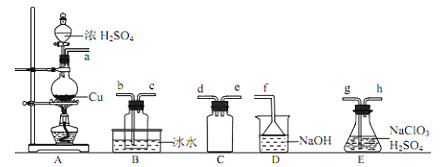
①装置A中反应的化学方程式为_______________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为 a→_________(按气流方向,用小写字母表示)
③装置D的作用是_________。
(2)ClO2与 Na2S 的反应
将上述收集到的ClO2用 N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
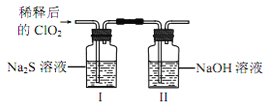
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中, 加入Ba(OH)2溶液,振荡 | ①_________ | 有硫酸根离子生成 |
另取少量Ⅰ中溶液于试管乙中, 滴加品红溶液和盐酸 | 品红溶液不翅色 | ② 无_____生成 |
若在试管甲中继续加Ba(OH)2溶液至 过量,静置,取上层清液于试管丙③______ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写2条)。