题目内容
20.已知A、B、C、D、E是短周期中原子序数依次增大的5中主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )| A. | 1mol由元素A、B组成的化合物一定含有18mole- | |
| B. | 化合物AE与DE3有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素D的最高价氧化物对应的水化物可以溶于过量的氨水中 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al;元素B的原子最外层电子数是其电子层数的2倍,原子序数小于Al,故B有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于碳,则C为Na元素;其中元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数大于铝元素,E为Cl元素,据此解答.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al;元素B的原子最外层电子数是其电子层数的2倍,原子序数小于Al,故B有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于碳,则C为Na元素;其中元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数大于铝元素,E为Cl元素.
A.元素H、C组成的化合物属于烃,1mol烃中含有的电子数不一定是18mole-,如1mol甲烷含有10mol电子等,故A错误;
B.化合物AE是HCl,属于共价化合物,含有共价键,化合物DE3为AlCl3,属于共价化合物,含有共价键,二者含有的化学键类型相同,故B正确;
C.工业上电解熔融NaCl制备Na,电解熔融氧化铝制备Al,电解饱和氯化钠溶液制备氯气,故C正确;
D.D的最高价氧化物对应的水化物是氢氧化铝,氢氧化铝不溶于氨水,故D错误;
故选:BC.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,C选项中注意中学常见的化学工业,难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
11.某酸性溶液中含有NH4+、Cl-、H+、OH-四种离子,下列叙述正确的是( )
| A. | 该溶液可能由pH=3盐酸与pH=11的NH3•H2O溶液等体积混合而成 | |
| B. | 该溶液可能由等物质的量浓度的NH3•H2O与盐酸以2:1的体积比混合 | |
| C. | 该溶液中由水电离出的氢离子浓度一定大于1.0×10-7mol•L-1 | |
| D. | 加入一定量NH3•H2O,c(NH4+)可能大于、等于或小于c(Cl-) |
15.化学与生化、社会密切相关,下列说法不正确的是( )
| A. | 维生素在天然食品中含量丰富,所以加工后的食品中维生素的含量也高 | |
| B. | 2M+N=2P+2Q,2P+M=Q(M、N为原料,Q为期望产品)符合“化学反应的绿色化”的要求 | |
| C. | 稀的双氧水可用于清洗伤口,以达到杀菌、消毒的目的 | |
| D. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
5.利用下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 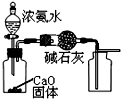 制取并收集干燥的NH3 | |
| B. | 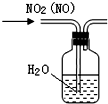 可除去NO2中的NO | |
| C. | 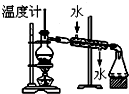 分离两种互溶但沸点相差较大的液体混合物 | |
| D. | 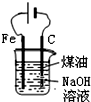 制备Fe(OH)2并能较长时间观察其颜色 |
12.下列有关化学用语表示正确的是( )
| A. | 氟原子的结构示意图: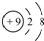 | |
| B. | 邻硝基甲苯的结构简式: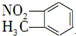 | |
| C. | 质子数为27、中子数为33的Co原子:${\;}_{27}^{60}$Co | |
| D. | H2O2的电子式: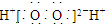 |
9.下列指定反应的离子方程式书写正确的是( )
| A. | 用白醋除铁锈:Fe2O3•xH2O+6H+═(3+x)H2O+2Fe3+ | |
| B. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++2OH-+N${{H}_{4}}^{+}$+H++S${{O}_{4}}^{2-}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 纯碱溶液和苯酚反应:C${{O}_{3}}^{2-}$+2C6H5OH→2C6H5O-+CO2↑+H2O | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
10.下列解释事实的方程式不正确的是( )
| A. | 向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 常温下0.1mol/L 氯化铵溶液pH=5:NH4++H2O?NH3•H2O+H+ | |
| D. | 电解精炼铜时阳极铜溶解:Cu-2e-═Cu2+ |

 ;
;