题目内容
4.为了测定某有机物A的结构,做如下实验:①将3.1g该有机物完全燃烧,生成0.1mol CO2和2.7g水;
②用质谱仪测定其相对分子质量,得如图所示的质谱图;
③其核磁共振氢谱如图

试回答下列问题:
(1)有机物A的相对分子质量是62.
(2)有机物A的实验式是CH3O.
(3)有机物的结构简式为CH2OHCH2OH
(4)若以分子量为28的某烃为原料合成机物A,则所经过的反应类型为加成反应→取代反应(填反应名称用→连接)
分析 (1)根据质荷比可知,有机物A的相对分子质量;
(2)根据n=$\frac{m}{M}$计算生成的水的物质的量,计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素,若含有氧元素,计算氧元素质量、氧原子物质的量,根据原子守恒确定有机物A中C、H、O原子个数比值确定最简式;
(3)由核磁共振氢谱可知,该有机物分子中有2中化学环境不同的H原子,2种H原子数目之比为2:1,结合有机物的分子式确定其可能的结构;
(4)分子量为28的气态烃是C2H4,乙烯和氯气发生加成反应再水解生成乙二醇.
解答 解:(1)在A的质谱图中,最大质荷比为62,所以其相对分子质量也是62,故答案为:62;
(2)3.1g有机物燃烧生成0.1mol CO2,?2.7g水,
则n(C)=n( CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,n(H)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,
则m(C)+m(H)=1.2g+0.3g=1.5g<3.1g,故有机物含有O元素,且m(O)=3.1g-1.5g=1.6g,故n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,
n(C):n(H):n(O)=0.1mol:0.3mol:0.1mol=1:3:1,即该有机物最简式为CH3O,
故答案为:CH3O;
(3)根据相对分子质量是62,最简式为CH3O,有机物的分子式为C2H6O2,由核磁共振氢谱可知,该有机物分子中有2中化学环境不同的H原子,2种H原子数目之比为2:1,有机物A的分子式为C2H6O2,故该有机物结构式为CH2OHCH2OH,
故答案为:CH2OHCH2OH;
(4)分子量为28的气态烃是C2H4,乙烯和氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷水解生成乙二醇,
故答案为:加成反应→取代反应.
点评 本题考查有机物分子式与结构确定等,难度中等,注意燃烧法利用原子守恒确定有机物的分子式,侧重对基础知识与学生综合能力考查,注意对有机谱图的简单认识.

| A. | 22.4 L氧气中,一定含有2mol氧原子 | |
| B. | 80 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L | |
| C. | 18 g水在标准状况下的体积约为22.4L | |
| D. | 标准状况下,20 mLNH3跟60 mLO2所含分子个数比为1:3 |
①水玻璃 ②水泥 ③普通玻璃 ④漂白粉 ⑤Na2CO3•10H2O ⑥氯水 ⑦液氯⑧纯净的盐酸.
| A. | ⑤⑦ | B. | ①⑤⑦⑧ | C. | ①⑤⑥ | D. | ①④ |
 某同学在实验室进行实验研究化学反应速率的影响因素.
某同学在实验室进行实验研究化学反应速率的影响因素.Ⅰ.下表是研究性学习小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(单位:s)
浓 度 反应条件 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加 热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)该研究小组在设计方案时,考虑了浓度、温度、催化剂等反应条件对过氧化氢分解速率的影响.
(3)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?温度升高化学反应速率加快(或反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快).
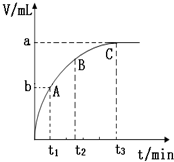
(4)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是C.
(5)若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,反应的离子方程式为MnO2+2H++H2O2=Mn2++O2↑+2H2O.
Ⅱ.现提供下列实验用品研究化学反应速率的影响因素.
实验仪器:试管、烧杯、量筒、天平、秒表
实验药品:铝片、铝粉、0.5mol/L 盐酸、5mol/L 盐酸
①利用所提供实验用品,可研究的化学反应速率的影响因素是盐酸的浓度、铝的表面积,
为了便于观察,你建议记录的数据是反应开始到停止所用的时间.
②若要研究温度对化学反应速率的影响,还需用到的主要仪器是温度计.
| A. | 原子半径依次增大 | B. | 离子半径依次增大 | ||
| C. | 单质的密度依次逐渐增大 | D. | 氢氧化物的碱性依次增强 |
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:MgO>NaCl>KCl | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
| A. | 最高正价是+5价 | B. | 最低负价为-2价 | ||
| C. | 该元素位于第二周期 | D. | 该元素属于ⅤA族元素 |
| A. | SO2 | B. | CaCl2 | C. | SiO2 | D. | Na2O2 |
| A. | 1mol由元素A、B组成的化合物一定含有18mole- | |
| B. | 化合物AE与DE3有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素D的最高价氧化物对应的水化物可以溶于过量的氨水中 |