题目内容
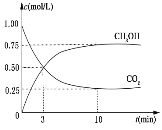
【题目】降低大气中 CO2 的含量及有效地开发利用 CO2,已受到各国的普遍重视。目前工业上有一种方法是用 CO2 来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为 1L 的恒容密闭容器中,充入 1mol CO2 和 3mol H2,一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2 和 CH3OH(g)的浓度随时间变化如下图所示。
(1)在恒温恒容条件下,下列能说明反应达到化学平衡状态的是 _________(选填字母)
A.体系压强不再改变 B.气体密度不再改变 C.CO2 的浓度不再改变 D.v 正(CO2)= v 逆(H2)
(2) 从反应开始到平衡,氢气的平均反应速率 v(H2)=________mol/(L·min)。
(3)在该温度下,该反应的平衡常数为_________(保留小数点后 2 位)。
(4)下列措施中能使平衡体系中 n(CH3OH)/n(CO2)增大的是_________(选填字母)。
A.升高温度 B.充入 He(g),使体系压强增大 C.将 H2O(g)从体系中分离出去 D.再充入 1mol H2
(5)当反应达到平衡时,H2 的物质的量浓度为 c1,然后向容器中再加入一定量 H2,待反应再一次达到平衡后,H2 的物质的量浓度为 c2,则 c1________________c2(填“>”、“<”或“=”)。
【答案】AC 0.075 5.33 CD <
【解析】
(1)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,判断化学平衡状态是变化量不再发生改变,则说明到达平衡;
(2)由图先求出甲醇的反应速率,再由化学反应速率之比等于化学计量数之比,求的氢气反应速率;
(3)列出三段式,找到平衡时各物质的平衡浓度,即可求出平衡常数;
(4)要使n(CH3OH)/n(CO2)增大应采取措施,即使平衡向正反应移动;
(5)由勒夏特列原理,反应只能向着减弱这种影响的方向移动,不能消除影响;
(1)在恒温恒容条件下,CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,反应是气体体积减小的放热反应,
A.该反应是气体体积减小的放热反应,当体系压强不再改变,说明各气体的组分不再变化,说明反应达到平衡状态,A正确;
B.反应前后气体体积和质量不变,气体的密度始终不变化,不能说明反应达到平衡状态,B错误;
C.CO2 的浓度不再改变,则消耗CO2的量与生成CO2的量相等,二氧化碳正逆反应速率相同,说明反应达到平衡状态,C正确;
D.化学反应速率之比等于化学计量数之比,则3v 正(CO2)= v 正(H2),故当3v 正(CO2)= v 正(H2)= v 逆(H2)时正逆反应速率相等,才能说明反应达到平衡状态,D错误;
故答案为AC;
(2)由图可知反应到10min后达到平衡,甲醇的反应速率为:![]() ,由化学反应速率之比等于化学计量数之比,则氢气的平均反应速率 v(H2)= v(CH3OH)=0.075 mol/(L·min),答案为0.075;
,由化学反应速率之比等于化学计量数之比,则氢气的平均反应速率 v(H2)= v(CH3OH)=0.075 mol/(L·min),答案为0.075;
(3)由图中数据,列出该反应的三段式:
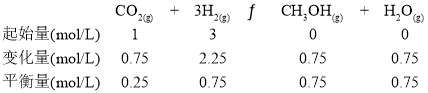
则该反应的平衡常数:![]() ,答案为5.33;
,答案为5.33;
(4)使n(CH3OH)/n(CO2)增大应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量,
A.该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol H2,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
答案选CD;
(5)由勒夏特列原理,反应只能向着减弱这种影响的方向移动,不能消除影响,故平衡后,再加入H2,平衡正向移动,开始的瞬间氢气浓度下降,但后来氢气加入,它的浓度最终会增多,故c1<c2,答案:<。