题目内容
9.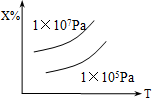 已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )
已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )| A. | Z是气态,n=3,正反应△H<0 | B. | Z是气态,n>3,正反应△H<0 | ||
| C. | Z是气态,n=3,正反应△H>0 | D. | Z不是气态,n<3,正反应△H>0 |
分析 由图象曲线的变化特点可知,升高温度,X的质量分数增大,说明升高温度平衡向逆反应方向移动,说明该反应的正方向为放热反应;增大压强,X的质量分数增大,则平衡向生成X的方向移动即气体体积减小的方向,据此分析.
解答 解:由图象曲线的变化特点可知,升高温度,X的质量分数增大,说明升高温度平衡向逆反应方向移动,说明该反应的正方向为放热反应,则正反应△H<0;增大压强,X的质量分数增大,则平衡向生成X的方向移动即气体体积减小的方向,所以Z是气态,n>3;
故选B.
点评 本题考查化学平衡移动,难度不大.注意分析曲线变化特点,从温度和压强的变化的趋势进行分析判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列各组物质相互反应时,改变反应的条件或者反应物的物质的量之比,生成的产物不变的是( )
| A. | Na与氧气 | B. | 澄清石灰水与二氧化碳 | ||
| C. | 碳与氧气 | D. | 过氧化钠和水 |
20.水资源非常重要,联合国确定2003年为国际淡水年.海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法和压渗法等.下列方法中,不可以用来进行海水淡化的是( )
| A. | 过滤法 | B. | 蒸馏法 | C. | 膜分离法 | D. | 离子交换法 |
14.下列有关物质性质的描述中,正确的是( )
| A. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| B. | CO、NO、SO2都是大气污染物,在空气中都能稳定存在 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此不能与酸溶液发生反应 |
1.下列离子方程式书写正确的是( )
| A. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:2Al3++2NH4++4SO42-+4Ba2++10OH-═2AlO2-+4BaSO4↓+2NH3•H2O+4H2O | |
| B. | 碳酸氢镁溶液中加过量澄清石灰水:Mg2++2OH-+2HCO3-+Ca2+═MgCO3↓+2H2O+CaCO3↓ | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| D. | 碳酸钠的水解反应:CO32-+H3O+?HCO3-+H2O |
18.下列离子方程式的书写正确的是( )
| A. | Ba(OH)2与H2SO4两稀溶液混合:Ba2++OH-+H++S042-═BaS04↓+H2O | |
| B. | AlCl3溶液中加入过量氨水:Al3++3NH3.HO═Al(OH)3↓+3NH4+ | |
| C. | 将Na投入到CuS04溶液:2Na+Cu2+═2Na++Cu | |
| D. | 等物质的量的MgCl2、NaOH和HCl溶液混合:Mg2++20H一═Mg(OH)2↓ |
19.下列实验中,颜色的变化与氧化还原反应有关的是( )
| A. | 往紫色石蕊试液中通入氨气,溶液变蓝 | |
| B. | 饱和FeCl3溶液在沸水中变成红褐色胶体 | |
| C. | 向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 | |
| D. | SO2使滴有酚酞的NaOH溶液褪色 |
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.