题目内容
17.含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是0.6mol.0.3mol NH3分子中所含氢原子数与2.709×1023个H2O分子中所含氢原子数相等.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)$\frac{22.4bc}{a{N}_{A}}$L.分析 由化学式可知,Al3+、SO42-的物质的量之比为2:3,据此计算;根据氨气中含有氢原子物质的量计算水的物质的量,根据N=nNA计算水分子数目;
根据n=$\frac{N}{{N}_{A}}$计算ag气体的物质的量,质量之比等于其物质的量之比,据此计算cg该气体的物质的量,根据V=n×Vm来计算体积.
解答 解:由化学式可知,Al3+、SO42-的物质的量之比为2:3,0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是:0.4mol×$\frac{3}{2}$=0.6mol;
与0.3molNH3分子中所含氢原子数相等的水分子物质的量=$\frac{0.3mol×3}{2}$=0.45mol,故水分子数目=0.45mol×6.02×1023mol-1=2.709×1023,
a克某气体中含有的分子数为b,则c克气体含有的分子数为$\frac{cb}{a}$,c克该气体的物质的量为$\frac{\frac{bc}{a}}{{N}_{A}}$=$\frac{bc}{a{N}_{A}}$mol,在标准状况下Vm=22.4L/mol,则cg该气体的体积为$\frac{bc}{a{N}_{A}}$mol×22.4L/mol=$\frac{22.4bc}{a{N}_{A}}$L,
故答案为:0.6mol;2.709×1023;$\frac{22.4bc}{a{N}_{A}}$.
点评 本题考查物质的量的计算,侧重于学生的分析、计算能力的考查,注意对公式的理解与灵活应用,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7. 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)?2Z(g)△H=-192kJ•mol-1.向M、N中都通入a mol X和b mol Y的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变.下列说法一定正确的是( )
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)?2Z(g)△H=-192kJ•mol-1.向M、N中都通入a mol X和b mol Y的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变.下列说法一定正确的是( )
 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)?2Z(g)△H=-192kJ•mol-1.向M、N中都通入a mol X和b mol Y的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变.下列说法一定正确的是( )
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)?2Z(g)△H=-192kJ•mol-1.向M、N中都通入a mol X和b mol Y的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变.下列说法一定正确的是( )| A. | 平衡时,X的体积分数:M<N | |
| B. | 若向N中再充入a mol X和b mol Y,则平衡时,X的转化率:M<N | |
| C. | 若a:b=1:3,当M中放出172.8 kJ热量时,X的转化率为90% | |
| D. | 若a=1.2,b=1,并且N中达到平衡时体积为2 L,此时含有0.4 mol Z,则再通入0.36 mol X时,v(正)<v(逆) |
8.下列实验操作正确的是( )
| A. | 蒸馏操作时,温度计水银球应插入到液体中 | |
| B. | 萃取操作时,应选择溶质在其中更易溶的溶剂作萃取剂,且萃取剂与原溶剂互不相溶,其密度比原溶剂要大 | |
| C. | 用固体NaOH配制一定物质的量浓度的NaOH溶液,将NaOH固体溶于水后,立即将溶液转移到容量瓶中 | |
| D. | 称取28.6gNa2CO3•10H2O溶于水配制成100 mL1mol•L-1的Na2CO3溶液 |
5.在卤代烃R-CH2-CH2-X中,其化学键如图所示,当该卤代烃断键方式正确的是( )


| A. | 在氢氧化钠溶液中加热时,被破坏的键是①和③ | |
| B. | 在氢氧化钠乙醇溶液中加热时,被破坏的键是①和④ | |
| C. | 在氢氧化钠溶液中加热时,被破坏的键是① | |
| D. | 在氢氧化钠乙醇溶液中加热时,被破坏的键是①和② |
12.粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质.为了除去杂质在实验室中可将粗盐溶于水然后进行下列操作:(1)过滤;(2)加入过量的氢氧化钠溶液;(3)加入适量的盐酸;(4)加过量Na2CO3溶液;(5)加过量的BaCl2溶液,以上操作的正确顺序是( )
| A. | (5)(4)(2)(1)(3) | B. | (1)(2)(3)(4)(5) | C. | (5)(4)(3)(2)(1) | D. | (1)(5)(4)(2)(3) |
9.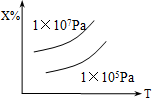 已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )
已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )
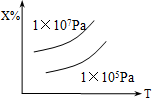 已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )
已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )| A. | Z是气态,n=3,正反应△H<0 | B. | Z是气态,n>3,正反应△H<0 | ||
| C. | Z是气态,n=3,正反应△H>0 | D. | Z不是气态,n<3,正反应△H>0 |

 .
. .
. 如图为实验室制取蒸馏水的实验装置图:
如图为实验室制取蒸馏水的实验装置图: