题目内容
4. 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.(1)常温下,可用铁质容器盛装浓硫酸的原因是浓硫酸具有强氧化性,常温下在铁表面生成一层致密的氧化膜.
(2)某实验小组利用如图装置验证铁与水蒸气的反应.
①湿棉花的作用是提供水蒸气,试管中反应的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4+4H2.
②实验结束后,取出少量反应后的固体于试管中,加入过量盐酸,固体完全溶解,所得溶液中存在的阳离子是b(填序号).
a.一定有Fe2+、H+和Fe3+ b.一定有Fe2+、H+,可能有Fe3+
c.一定有Fe2+、Fe3+,可能有 H+ d.一定有Fe3+、H+,可能有Fe2+
(3)另称取一定量的铁钉放入足量的浓硫酸中,加热,充分反应后收集气体.经测定气体中含有SO2、CO2和H2.
①铁与足量的浓硫酸反应的化学方程式是2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe2(SO4)3+3SO2↑+6H2O.
②将672mL(标准状况)收集到的气体通入足量溴水中,发生反应:
SO2+Br2+2H2O═2HBr+H2SO4,然后加入足量BaCl2溶液,经洗涤、干燥得到固体4.66g.由此推知收集到的气体中SO2的体积分数是66.7%.(结果保留三位有效数字)
分析 (1)浓硫酸具有强的氧化性,常温下遇到铁发生钝化;
(2)①铁与水蒸气在高温条件下反应生成四氧化三铁和氢气;
②产物四氧化三铁中有+2价的铁和+3价的铁,还有可能有过量的铁;
(3)①铁与浓硫酸在加热条件下发生氧化还原反应生成硫酸铁、二氧化硫和水;
②依据反应:SO2+Br2+2H2O═2HBr+H2SO4,结合反应BaCl2+H2SO4=BaSO4+2HCl,利用硫元素的守恒,求出SO2的体积分数.
解答 解:(1)浓硫酸具有强的氧化性,常温下遇到铁发生钝化,在铁表面生成一层致密的氧化膜,阻止反应继续进行,所以可用铁质容器盛装浓硫酸;
故答案为:因为浓硫酸具有强氧化性,常温下在铁表面生成一层致密的氧化膜;
(2)①铁与水蒸气在高温条件下反应生成四氧化三铁和氢气,湿棉花能够为反应提供水蒸气,二者反应方程式:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4+4H2;
故答案为:提供水蒸气; 3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4+4H2;
②铁和水蒸气反应,产物为四氧化三铁和氢气,加入过量盐酸,固体完全溶解,必发生反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,所以所得溶液中存在的阳离子是一定有Fe2+、H+,四氧化三铁黑色固体中可能含有过量的铁,可能将三价铁离子全部转化成二价铁离子,Fe+2Fe3+═3Fe2+,所以所得溶液中存在的阳离子是一定有Fe2+、H+,可能有Fe3+,
故答案为:b;
(3)①铁与浓硫酸在加热条件下发生氧化还原反应生成硫酸铁、二氧化硫和水,化学方程式:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe2(SO4)3+3SO2↑+6H2O;
故答案为:2Fe+6H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe2(SO4)3+3SO2↑+6H2O;
②672mL(标准状况)混合气体的物质的量为$\frac{0.672L}{22.4L/mol}$=0.03mol;
SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,发生反应:BaCl2+H2SO4=BaSO4+2HCl,所以:
SO2 ~BaSO4
1mol 233g
n 4.66g
解得:n=0.02mol;
所以收集到的气体中SO2的体积分数为:$\frac{0.02mol}{0.03mol}$×100%=66.7%;
故答案为:66.7%.
点评 本题考查了铁及其化合物性质,明确物质的性质是解题关键,注意解答有关方程式计算时,关键在于把握相关物质量的关系,题目难度不大.

| A. | 配制1 L该溶液,可将0.1 mol CaCl2溶于1 L水中 | |
| B. | Ca2+和Cl-的物质的量浓度都是0.1 mol•L-1 | |
| C. | 从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05 mol•L-1 | |
| D. | 将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.1 mol•L-1 |
| A. | (5)(4)(2)(1)(3) | B. | (1)(2)(3)(4)(5) | C. | (5)(4)(3)(2)(1) | D. | (1)(5)(4)(2)(3) |
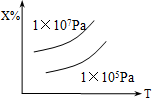 已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )
已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )| A. | Z是气态,n=3,正反应△H<0 | B. | Z是气态,n>3,正反应△H<0 | ||
| C. | Z是气态,n=3,正反应△H>0 | D. | Z不是气态,n<3,正反应△H>0 |
| A. | FeCl2 | B. | Al2O3 | C. | Na2O | D. | SiO2 |
| A. | 12A/B g•mol-1 | B. | A/NA g•mol-1 | C. | 12B/A g•mol-1 | D. | A NA g•mol-1 |
 .
.