题目内容
19.下列实验中,颜色的变化与氧化还原反应有关的是( )| A. | 往紫色石蕊试液中通入氨气,溶液变蓝 | |
| B. | 饱和FeCl3溶液在沸水中变成红褐色胶体 | |
| C. | 向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 | |
| D. | SO2使滴有酚酞的NaOH溶液褪色 |
分析 A.碱遇紫色石蕊变蓝;
B.铁离子水解生成胶体;
C.发生复分解反应生成氢氧化亚铁,氢氧化亚铁被氧化为红褐色的氢氧化铁;
D.发生复分解反应生成亚硫酸钠和水
解答 解:A.碱遇紫色石蕊变蓝,只与碱性有关,故A不选;
B.铁离子水解生成胶体,只与水解有关,故B不选;
C.发生复分解反应生成氢氧化亚铁,氢氧化亚铁被氧化为红褐色的氢氧化铁,涉及了氧化还原反应,故C选;
D.发生复分解反应生成亚硫酸钠和水,NaOH在反应中消耗,则溶液褪色,只与复分解反应和碱溶液的性质有关,故D不选;
故选C.
点评 本题考查氧化还原反应,明确颜色变化涉及的化学反应是解答的关键,注意酸碱指示剂的变色和反应的实质,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
9.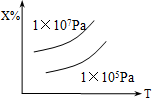 已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )
已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )
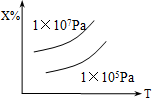 已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )
已知X(g)+2Y(g)?nZ的反应达到平衡状态时,体系中X的质量分数与温度(T),压强的关系如下图所示,下列说法中正确的是( )| A. | Z是气态,n=3,正反应△H<0 | B. | Z是气态,n>3,正反应△H<0 | ||
| C. | Z是气态,n=3,正反应△H>0 | D. | Z不是气态,n<3,正反应△H>0 |
14.某元素一个原子的质量Ag,一个C-12原子的质量为Bg,NA表示阿伏加德罗常数,则该原子的摩尔质量为( )
| A. | 12A/B g•mol-1 | B. | A/NA g•mol-1 | C. | 12B/A g•mol-1 | D. | A NA g•mol-1 |
4.厨房中的物质放入足量的水中,充分搅拌,不能形成溶液的是( )
| A. | 食用油 | B. | 白醋 | C. | 白糖 | D. | 食盐 |
11.向某溶液中加入BaCl2溶液后观察到白色沉淀,则( )
| A. | 该溶液中一定含硫酸根离子 | |
| B. | 该溶液中一定含有银离子 | |
| C. | 该溶液中一定含有硫酸根离子和银离子 | |
| D. | 该溶液中可能含有硫酸根离子或银离子 |
8.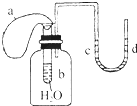 如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
 如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )| A. | 气球a被吹大 | B. | 试管b内有气泡冒出 | ||
| C. | U形管内红色褪去 | D. | U形管水位d高于c |
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视. .
. 如图为实验室制取蒸馏水的实验装置图:
如图为实验室制取蒸馏水的实验装置图: 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收: