题目内容
18.下列电离方程式书写正确的是( )| A. | KClO3═K++Cl5-+3O2- | B. | HNO3═H++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | CaCl2═Ca2++Cl- |
分析 A.氯酸钾为强电解质,完全电离出钾离子、氯酸根离子,氯酸根离子不能拆写;
B.硝酸为一元强酸,完全电离出氢离子和硝酸根离子;
C.钠离子角标应转化为化学计量数;
D.氯化钙为强电解质,完全电离出钙离子和氯离子,方程式左右电荷不守恒.
解答 解:A.氯酸钾为强电解质,完全电离出钾离子、氯酸根离子,电离方程式为:KClO3═K++ClO3-,故A错误;
B.硝酸为强酸,完全电离出氢离子和硝酸根离子,电离方程式为:HNO3=H++NO3-,故B正确;
C.碳酸钠为强电解质完全电离出钠离子和碳酸根离子,电离方程式为:Na2CO3═2Na++CO32-,故C错误;
D.氯化钙电离出氯离子和钙离子,电离方程式为:CaCl2=Ca2++2Cl-,故D错误;
故选B.
点评 本题考查电离方程式的书写,掌握正确书写电离方程式的方法,并会正确判断离子方程式的正误是解答的关键,题目难度不大.

练习册系列答案
相关题目
9.在下列条件下,两种气体的分子数一定相等的是( )
| A. | 同温度、同体积、同压强的O2与N2 | B. | 同质量、不同密度的N2和C2H4 | ||
| C. | 同体积、同密度的CO和 CH4 | D. | 同压强、同体积的N2和O2 |
6.实验室盛装浓硝酸的试剂瓶应贴有的安全使用标识是( )
| A. |  | B. |  | C. |  | D. |  |
13.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法正确的是( )


| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
3.在标况下,下列物质中,与0.3moLH2O含相同氢原子数的物质是( )
| A. | 0.6mol H2SO4 | B. | 3.612×1023个HNO3分子 | ||
| C. | 7.3g HCl | D. | 4.48L CH4 |
10.下列实验方法,能达到目的是( )
| A. | 用托盘天平称量25.20 g氯化钠固体 | |
| B. | 将干燥的氯气依次通过干燥红色布条和湿润红色布条检验氯气能否与水发生反应 | |
| C. | 用饱和溶液FeCl3和NaOH溶液混合制备Fe(0H)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
7.100℃时,将0.1mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)?2NO2 (g).下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
| A. | N2O4的消耗速率与NO2的生成速率之比为1:2 | |
| B. | 烧瓶内气体的颜色不再加深 | |
| C. | 烧瓶内气体的平均相对分子质量不再变化 | |
| D. | 烧瓶内气体的压强不再变化 |
8.下列物质不能使潮湿的有色布条褪色的是( )
| A. | 干燥的氯气 | B. | 久置的氯水 | C. | 液氯 | D. | 次氯酸溶液 |
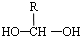 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$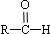 (R代表烃基).
(R代表烃基).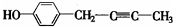 、
、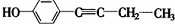 .
.