题目内容
3.在标况下,下列物质中,与0.3moLH2O含相同氢原子数的物质是( )| A. | 0.6mol H2SO4 | B. | 3.612×1023个HNO3分子 | ||
| C. | 7.3g HCl | D. | 4.48L CH4 |
分析 0.3molH2O含相同氢原子数为0.3mol×2NA=0.6NA,结合对应物质的构成计算.
解答 解:A.0.6mol H2SO4中含有1.2NA氢原子,故A错误;
B.3.612×1023个HNO3分子中含有0.6NA氢原子,故B正确;
C.7.3g HCl的物质的量为:0.2mol,含有0.2NA氢原子,故C错误;
D.在标况下,4.48L物质的量为:0.2mol,则0.2molCH4含有0.8NA氢原子,故D错误.
故选:B.
点评 本题考查物质的量的相关计算,解答本题中注意物质的分子构成,结合相关的计算公式解答,难度不大.

练习册系列答案
相关题目
14.下列有关实验操作或判断正确的是( )
| A. | 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 | |
| B. | 需要95 mL 0.1 mol•L-1 NaCl溶液,可选用100 mL容量瓶来配制 | |
| C. | 用100 mL的量筒量取5.2 mL的盐酸 | |
| D. | 用托盘天平称取25.20 g NaCl |
11.下列反应中,属于取代反应的是( )
| A. | CH4+2 O2$\stackrel{点燃}{→}$CO2+H2O | |
| B. | CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | |
| C. | 2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2 H2O | |
| D. |  |
18.下列电离方程式书写正确的是( )
| A. | KClO3═K++Cl5-+3O2- | B. | HNO3═H++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | CaCl2═Ca2++Cl- |
8.下列物质的分类中.正确的一组是( )
| 分类、选项 | 酸 | 碱 | 盐 | 碱性氧化物 |
| A | H2SO4 | Na2CO3 | NaHCO3 | CaO |
| B | HCl | NH3•H2O | NaCl | Na2O |
| C | CO2 | Cu(OH)2 | MgCl2 | Na2O |
| D | HNO3 | KOH | CaO | CO |
| A. | A | B. | B | C. | C | D. | D |
15.下列说法中正确的是( )
| A. | 化学反应速率通常只能用反应物浓度的减少量表示 | |
| B. | 加入反应物可使反应速率增大 | |
| C. | 在研究反应速率变化的实验中.同时改变两个变量一定能更快得出有关规律 | |
| D. | 对于反应2H2O2═2H2O+O2↑.加入MnO2或升高温度都能加快O2的生成速率 |
13.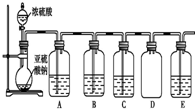 (1)某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告.
(1)某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告.
(2)该探究小组还根据SO2中S元素的化合价,预 测并通过实验探究SO2的其他性质.探究过程中选用的实验药品有:浓硫酸、亚硫酸钠固体、Na2S溶液、酸性高锰酸钾溶液、品红溶液等.探究过程的实验装置图如图所示,请回答下列问题.
①请你完成下列表格.
②A中发生反应的离子方程式为5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+.
③实验时C中的实验现象是品红溶液褪色.
④D装置的作用是防倒吸.E是尾气处理装置,有人认为E装置中可以加入足量的Ba(NO3)2溶液,你认为是否合理,请结合离子方程式加以说明:不合理,因为发生的反应为3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO↑+4H+,生成的NO仍然对环境有污染.
 (1)某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告.
(1)某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告.| 物质 | 类别 | 化学性 质预测 | 实验验证 | ||
| 实验操作 | 实验现象 | 实质(用离子 方程式表示) | |||
| 二氧 化硫 | 酸性 氧化物 | 与水 反应 | 将盛满SO2气体的试管倒立在水中,并测定试管中溶液的pH | ① | SO2+H2O ?H2SO3 |
| 与碱 反应 | ② | 出现白 色沉淀 | ③ | ||
①请你完成下列表格.
| 装置 | 药品 | 作用 |
| A | 验证二氧化硫的还原性 | |
| B | ||
| C | 品红溶液 |
③实验时C中的实验现象是品红溶液褪色.
④D装置的作用是防倒吸.E是尾气处理装置,有人认为E装置中可以加入足量的Ba(NO3)2溶液,你认为是否合理,请结合离子方程式加以说明:不合理,因为发生的反应为3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO↑+4H+,生成的NO仍然对环境有污染.

 .
. .
. ;
; (写结构简式)
(写结构简式)