题目内容
6.实验室盛装浓硝酸的试剂瓶应贴有的安全使用标识是( )| A. |  | B. |  | C. |  | D. |  |
分析 浓硝酸有腐蚀性,有强氧化性,据此解题.
解答 解:A.浓硝酸有强腐蚀性,为腐蚀品,故A正确;
B.浓硝酸常温下为液体,有强氧化性,但不是易燃品,故B错误;
C.浓硝酸不具有自燃性,故C错误;
D.浓硝酸有强腐蚀,但无毒,故D错误.
故选A.
点评 本题考查标识的意义和应用,难度不大,了解硝酸的性质、各个标志所代表的含义是解答此类题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为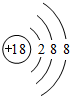 ;
;
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)②、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式);
(4)⑨与④两种元素的最高价氧化物的水化物碱性较强的是KOH(填化学式);
(5)①的单质与②最高价氧化物的水化物浓溶液反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;当消耗4.8g①的单质时,转移电子数为1.6NA.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;
;(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)②、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式);
(4)⑨与④两种元素的最高价氧化物的水化物碱性较强的是KOH(填化学式);
(5)①的单质与②最高价氧化物的水化物浓溶液反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;当消耗4.8g①的单质时,转移电子数为1.6NA.
14.下列有关实验操作或判断正确的是( )
| A. | 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 | |
| B. | 需要95 mL 0.1 mol•L-1 NaCl溶液,可选用100 mL容量瓶来配制 | |
| C. | 用100 mL的量筒量取5.2 mL的盐酸 | |
| D. | 用托盘天平称取25.20 g NaCl |
1.下列说法中正确的是( )
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 任何条件下,等物质的量的CO和NO所含的分子数一定相等 | |
| C. | 1L CO气体一定比1L O2的质量小 | |
| D. | 相同条件下的CO和N2,若体积相等,则质量一定相等 |
11.下列反应中,属于取代反应的是( )
| A. | CH4+2 O2$\stackrel{点燃}{→}$CO2+H2O | |
| B. | CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | |
| C. | 2 CH3CH2OH+O2$→_{△}^{Cu}$2 CH3CHO+2 H2O | |
| D. | 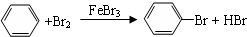 |
18.下列电离方程式书写正确的是( )
| A. | KClO3═K++Cl5-+3O2- | B. | HNO3═H++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | CaCl2═Ca2++Cl- |
15.下列说法中正确的是( )
| A. | 化学反应速率通常只能用反应物浓度的减少量表示 | |
| B. | 加入反应物可使反应速率增大 | |
| C. | 在研究反应速率变化的实验中.同时改变两个变量一定能更快得出有关规律 | |
| D. | 对于反应2H2O2═2H2O+O2↑.加入MnO2或升高温度都能加快O2的生成速率 |