题目内容
7.100℃时,将0.1mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)?2NO2 (g).下列结论不能说明上述反应在该条件下已经达到反应限度的是( )| A. | N2O4的消耗速率与NO2的生成速率之比为1:2 | |
| B. | 烧瓶内气体的颜色不再加深 | |
| C. | 烧瓶内气体的平均相对分子质量不再变化 | |
| D. | 烧瓶内气体的压强不再变化 |
分析 达到化学平衡状态时,正逆反应速率相等,各物质的浓度、质量、物质的量、百分含量不变,对于反应前后气体的化学计量数之和不相等的反应来说,达到平衡时压强也不变,据此进行判断.
解答 解:A、N2O4的消耗速率与NO2的生成速率之比为1:2,都体现的正反应方向,未体现正与逆的关系,故A错误;
B、烧瓶内气体的颜色不再加深,说明二氧化氮的浓度不变,达平衡状态,故B正确;
C、烧瓶内气体的平均相对分子质量不再变化,说明气体的物质的量不变,达平衡状态,故C正确;
D、烧瓶内气体的压强不再变化,说明气体的物质的量不变,达平衡状态,故D正确;
故选A.
点评 本题考查了化学平衡状态的判断,题目难度不大,完成本题的关键是熟练掌握化学平衡状态的实质以及判断的依据.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
7.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为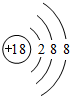 ;
;
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)②、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式);
(4)⑨与④两种元素的最高价氧化物的水化物碱性较强的是KOH(填化学式);
(5)①的单质与②最高价氧化物的水化物浓溶液反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;当消耗4.8g①的单质时,转移电子数为1.6NA.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;
;(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)②、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式);
(4)⑨与④两种元素的最高价氧化物的水化物碱性较强的是KOH(填化学式);
(5)①的单质与②最高价氧化物的水化物浓溶液反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;当消耗4.8g①的单质时,转移电子数为1.6NA.
18.下列电离方程式书写正确的是( )
| A. | KClO3═K++Cl5-+3O2- | B. | HNO3═H++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | CaCl2═Ca2++Cl- |
15.下列说法中正确的是( )
| A. | 化学反应速率通常只能用反应物浓度的减少量表示 | |
| B. | 加入反应物可使反应速率增大 | |
| C. | 在研究反应速率变化的实验中.同时改变两个变量一定能更快得出有关规律 | |
| D. | 对于反应2H2O2═2H2O+O2↑.加入MnO2或升高温度都能加快O2的生成速率 |
19.分子式为C8H18的烃,其中主链上有6个碳原子的同分异构体有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
16.下列各对物质中,互为同位素的是( )
①${\;}_{1}^{1}H$、${\;}_{1}^{2}H$ ②H2O、D2O ③${\;}_{17}^{35}Cl$、${\;}_{17}^{37}Cl$ ④金刚石、石墨 ⑤O2、O3⑥H2、H+.
①${\;}_{1}^{1}H$、${\;}_{1}^{2}H$ ②H2O、D2O ③${\;}_{17}^{35}Cl$、${\;}_{17}^{37}Cl$ ④金刚石、石墨 ⑤O2、O3⑥H2、H+.
| A. | ①②③ | B. | ①③ | C. | ③④⑤ | D. | ④⑤⑥ |
17.合理用药,服务健康.下列对于常用药物知识的叙述正确的是( )
| A. | 阿司匹林具有解热镇痛、抗炎、抗风湿效用,可长期服用没有副作用 | |
| B. | 青霉素能有效治疗细菌引发的感染,而对病毒引起的疾病无治疗效果 | |
| C. | 治疗胃酸过多的药物中通常含有氢氧化铝、碳酸镁、碳酸氢钠等成分 | |
| D. | 对于标记“OTC”的药物,必需凭医师的处方才能购买 |