题目内容
13.把100mL 98%的浓H2SO4(ρ=1.84g/cm3)与416mL的水(ρ=1.00g/cm3)混合成密度为1.20g/cm3的稀H2SO4.求稀H2SO4的质量分数和物质的量浓度.分析 根据m=ρVω计算出100mL该浓硫酸中含有硫酸的质量,再根据m=ρV计算出混合液的质量,然后根据ω=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算出该稀硫酸的质量分数;再根据c=$\frac{1000ρω}{M}$计算出该溶液的浓度.
解答 解:100mL 98%的浓H2SO4(ρ=1.84g/cm3)的质量为:1.84g/cm3×100mL=184g,该溶液中含有硫酸的质量为:184g×98%=180.32g,
416mL水的质量为:1.00g/cm3×416Ml=416g,所得混合液的质量为:180.32g+416g=596.32g,
该稀硫酸的质量分数为:$\frac{180.32g}{596.32g}$×100%≈30.2%;
该稀硫酸的物质的量浓度为:c=$\frac{1000×1.2×30.2%}{98}$mol/L=3.7mol/L,
答:所得稀H2SO4的质量分数为30.2%,物质的量浓度为3.7mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握溶质质量分数的计算方法,试题培养了学生的化学计算能力.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
3.实验操作的规范是实验的基本要求.下列实验操作正确的是( )
| A. | 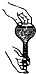 检查容量瓶是否漏水 | B. | 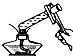 给溶液加热 | ||
| C. | 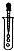 滴加液体 | D. | 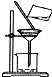 过滤 |
4.下列仪器中,不能加热使用的是( )
| A. | 锥形瓶 | B. | 试管 | C. | 容量瓶 | D. | 烧杯 |
1.将2.48g Na和Na2O2的混合物与足量的水反应,在标准状况下得到672mL混合气体,将混合气体用电火花引燃恰好完全反应,则Na和Na2O2的物质的量之比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 3:1 |
18.下列各组离子在水溶液里能大量共存.但用盐酸酸化后却不能大量共存的离子组是( )
| A. | Mg+、Al3+、Cl-、NO3- | B. | Fe2+、Na+、NO3-、SO42- | ||
| C. | Ba2+、Na+、K+、NO3- | D. | K+、Ca2+、CO32-、OH- |


 氯气的制取按照传统的方法,一般采用浓盐酸与MnO2共热来制备氯气,但是这种方法制过程中存在缺陷.某学习小组采用新的方法来制备氯气并进行性质实验.
氯气的制取按照传统的方法,一般采用浓盐酸与MnO2共热来制备氯气,但是这种方法制过程中存在缺陷.某学习小组采用新的方法来制备氯气并进行性质实验.