题目内容
11.原电池的正极一定是( )| A. | 电子流出的极 | B. | 电子流入的极 | ||
| C. | 发生氧化反应的极 | D. | 电极自身参与反应的极 |
分析 原电池的正极得电子发生还原反应,电子由负极流向正极,据此分析.
解答 解:原电池中,正极得电子发生还原反应,电子由负极流向正极,所以正极为电子流入的极,如果形成铜锌硫酸原电池,则正极自身不参与反应,故ACD错误,B正确;
故选:B.
点评 本题考查了原电池有关知识,明确原电池原理是解本题关键,注意原电池的正极得电子发生还原反应,电子由负极流向正极.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 平衡时,v正(O2)=v逆(NO)必成立 | |
| B. | 关系式5v正(O2)=4v正(NO)总成立 | |
| C. | 若投入4molNH3和5molO2,通过控制外界条件,必能生成4molNO | |
| D. | 用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最大 |
16.下列试剂能够使Fe3+转化为Fe2+的是( )
| A. | KSCN溶液 | B. | 氢氧化钠溶液 | C. | 氯水 | D. | 铜粉 |
1.1,2-二甲基环己烷(  )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )
 )的一氯代产物有(不考虑立体异构)( )
)的一氯代产物有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |

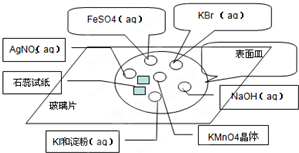 氯气的制取按照传统的方法,一般采用浓盐酸与MnO2共热来制备氯气,但是这种方法制过程中存在缺陷.某学习小组采用新的方法来制备氯气并进行性质实验.
氯气的制取按照传统的方法,一般采用浓盐酸与MnO2共热来制备氯气,但是这种方法制过程中存在缺陷.某学习小组采用新的方法来制备氯气并进行性质实验.