��Ŀ����
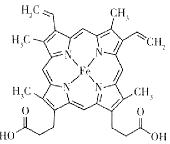
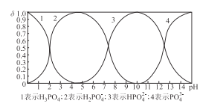
����Ŀ�������ӵ����Դ�ḻ���ڷ�ˮ�����Һ�о��и��ߵ����ӵ����ʵ��ŵ㡣һ�ּ����ӵ�صĹ���ԭ����ͼ��ʾ����֪�õ�ظ�����KC24-KC16-KC8֮��仯��������K2MnFe(CN)6-KMnFe(CN)6-MnFe(CN)6֮��仯������˵������ȷ���ǣ� ��
A.��ͼ��ʾΪ�����ӵ�صķŵ����
B.�ŵ�ʱ�����ɷ�����Ӧ��2KC8-e-=KC16+K+
C.���ʱ������ӦʽΪK2MnFe(CN)6-e-=KMnFe(CN)6+K+
D.�����ǰ������������ͬ������ʱÿת��0.lmole-�����������������������7.8g
���𰸡�A
��������
��װ��ͼ�е����ƶ��������������������������������װ��Ϊ�����ӵ�صij����̡��ŵ�ʱ������ʧȥ���ӣ�C�Ļ��ϼ����ߣ������ʱ仯˳��ΪKC8��KC16��KC24���ɵõ缫��Ӧ����Ϊ��2KC8-e��=KC16+K����3KC16-e���T2KC24+K���������õ����ӣ����ʻ��ϼ۽��ͣ����������ʱ仯˳��ΪMnFe(CN)6��KMnFe(CN)6��K2MnFe(CN)6���缫��Ӧ����Ϊ��MnFe(CN)6+K��+e��=KMnFe(CN)6��KMnFe(CN)6+K��+e��=K2MnFe(CN)6�����ʱ���缫��Ӧ��ŵ�ʱ�ķ�Ӧ�෴��
A����װ��ͼ�е����ƶ�����������������������������˵������������Ӧ����װ��Ϊ�����ӵ�صij����̣�����Aѡ��
B���ŵ�ʱ���������ʱ仯˳��ΪKC8��KC16��KC24����缫��Ӧ����Ϊ��2KC8-e��=KC16+K����3KC16-e��=2KC24+K�������Էŵ�ʱ�����ɷ�����Ӧ��2KC8-e��=KC16+K������ȷ��B��ѡ��
C�����ʱ����Ϊ��������Ӧʽ��������Ӧ�෴�����Է�ӦʽΪK2MnFe(CN)6-e��=KMnFe(CN)6+K������ȷ��C��ѡ��
D�����ʱ��ÿת��0.1mol���ӣ�����0.1molK�����������������룬��Ƕ�뵽���������У��������������������������0.2mol��39g��mol��1=7.8g����ȷ��D��ѡ��
��ѡA��

 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
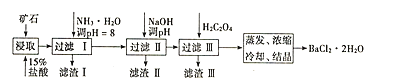
��ǰ�κ�ͬ����ϰϵ�д�����Ŀ��ij��ʯ����Ҫ�ɷ�ΪBaCO3(��Ca2+��Mg2+��Fe3+������)��ʵ�������øÿ�ʯ�Ʊ�BaCl22H2O��������ͼ����������������Ҫ�ɷָ�����ͬ��
���Ϊ����ʱ������ת��Ϊ�����������ʱ��pH��
Fe3+ | Mg2+ | Ca2+ | |
��ʼ����ʱ��pH | 1.9 | 9.1 | 11.9 |
��ȫ����ʱ��pH | 3.2 | 11.1 | 13.9 |
(1)��15%�����ȡǰ������ĥ��Ŀ����______��
(2)���������Ҫ�ɷ�Ϊ______������NaOH��pH�ķ�ΧΪ______������H2C2O4ʱӦ���������ԭ����______��[��֪�������ʣ�Ksp(BaC2O4)=1.6��10-7��Ksp(CaC2O4)=2.3��10-9]
(3)��֪��25��ʱ��Ksp(BaCO3)=5.4��10-9��Ksp(CaCO3)=2.7��10-9����CaCO3�������Һ�м����Ũ�ȵ�BaCl2��Һ����BaCO3�������ɣ���д���÷�Ӧ�����ӷ���ʽ______���÷�Ӧ��ƽ�ⳣ��K=______��
(4)ȡ�Ƶõ�BaCl22H2O(����������)2.5g���100mL��Һ��ȡ10.00mL����Һ���ձ��У���������(NH4)2C2O4��Һ�����ˣ�ϴ�ӣ����õ���BaC2O4�����ù���ϡ������Һ�ܽ⣬���˳�ȥBaSO4�����������õ�H2C2O4��Һ������ƿ����0.05mol/L������ر�Һ�ζ����յ㡣
��֪��Ba2++C2O42-�TBaC2O4��
BaC2O4+2H++SO42-�TBaSO4��+H2C2O4
5H2C2O4+2MnO4-+16H+�T10CO2��+2Mn2++8H2O
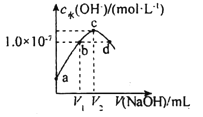
�ٵζ���ʢ�Ÿ�����ر�Һ������Ϊ______���������һ�θ��������Һ����ƿ����Һ��ɫ______����˵���ﵽ�ζ��յ㡣
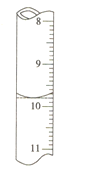
�����ζ�ǰ�ζ��ܵĶ���Ϊ1.80mL���ζ��յ�ʱ�ζ�����Һ����ͼ�������BaCl22H2O�Ĵ���Ϊ______(����3λ��Ч����)��
����Ŀ��ij���ӵĽṹ��ͼ��ʾ��-R Ϊ������������ A��B��D ����Ԫ��λ��Ԫ�����ڱ���ͬһ����������ڵ����ڣ�A �ķǽ����Դ��� B��D �� G �γɵ� DG3 �ڹ�ҵ�Ͽ�����Ư��ɱ��������A �� G �γɵ� AG3 ����ȫˮ�⣬��ˮ��IJ���֮һ H3AO3 ���������ϼ��ƽ����Ļ�ԭ����
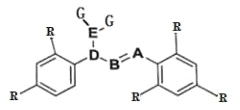
(1)����δ�ɶԵ��ӵ�ԭ�ӻ���Ӿ��д��ԡ�D ��ij�������� D2O4 �Ĵ��Դ�С���¶ȳ�����ع�ϵ�����������¶ȵ����������� D2O4 ![]() 2DO2����H______0��������������������=������
2DO2����H______0��������������������=������
(2)DG3 ����ɱ�������� HGO ��ȣ�DG3 �ɴ���ӳ�ɱ��������ʱ�䣬�Դӷ�Ӧ�������ۺ�ƽ���ƶ�����������ѡ��һ����������ԭ��____________________________��
(3)���������еķ��ǻ��ⲻ�ܷ������롣H3AO3 ������ A ԭ�������ĵ��Ӷ������˹��ۼ����γɣ����÷���ʽ��ʾ H3AO3 ��������Һ�ʼ��Ե�ԭ��_____��
(4)Һ���������2NH3(1) ![]() NH4++NH2-�ɵ��磬Һ̬ D2O4 ��Ҳ���� D2O4
NH4++NH2-�ɵ��磬Һ̬ D2O4 ��Ҳ���� D2O4![]() DO++DO3-�������������̵ı�������Ϊ___________��
DO++DO3-�������������̵ı�������Ϊ___________��
(5)T��ʱ����һ���Ϊ VL ���ܱ������з���һ������ ACl5 ���壬����ʽ������Ӧ��ACl5��s��![]() ACl3��g��+Cl2��g������H>0����������������ѹǿ�仯���±���
ACl3��g��+Cl2��g������H>0����������������ѹǿ�仯���±���
ʱ�� t/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 | �� |
��ѹ P/kPa | 0 | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 | 5.0 | 5.0 |
���������£��Է�ѹ��ʾ��ƽ�ⳣ�� Kp=_____(kPa)2��������������λС������ �������¶Ȳ��䣬30s ʱ��������ѹ������ƽ��������ڵ���ѹ��_____�����������������������������������������������ɾ�����������ѹ�������ڵ���ѹ��_____������������������������������������
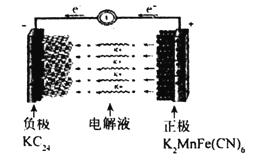
����Ŀ����ͼ��ʾ��ij��ѧ��ȤС�������һ��ȼ�ϵ�أ���̽���ȼҵԭ���ʹ�ͭ����ԭ����������װ����XΪ�����ӽ���Ĥ������Ҫ��ش��������:

��1��ͨ�������ĵ缫Ϊ_____���������������������������˵缫��ӦʽΪ_________��
��2�����缫Ϊ_______����������������������������װ���е�ⷴӦ�Ļ�ѧ����ʽΪ_________________��
��3��ij��ͭ�к������������Ͳ������ʣ�ͨ����⾫�ƺ�Ϊ�ӵ��Һ���Ƶ�����ͭ����(CuSO4��5H2O)����������¹������̣�
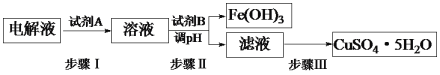
��֪�����ֽ��������ӿ�ʼ�����ͳ�����ȫ��pH��
�������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
Fe3�� | 1.9 | 3.2 |
Fe2�� | 7.6 | 9.6 |
Cu2�� | 4.7 | 6.7 |
�ٲ���I�м����Լ�A��Ŀ����_____________________________���Լ�AӦѡ��______(�����)��
a������ b���������� C�����Ը��������Һ
�ڲ���II���Լ�BΪ_________�����һ�ּ��ɣ�������pH�ķ�Χ��___________��
�۲���III�IJ����Ǽ���Ũ����___________�����ˡ�