题目内容
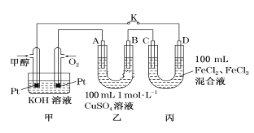
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
【答案】浓盐酸 抑制氯化铁水解 ce 溶液由棕黄色变为浅绿色 2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ 取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水(或H2O2溶液等),溶液变红 不合理 硝酸可以将溶解的SO2氧化为H2SO4,干扰实验 使气体充分吸收,防止溶液倒吸 bc
【解析】
(1)氯化铁在水溶液中易发生水解,因此配制氯化铁溶液时,一般先把氯化铁晶体溶于浓盐酸中,再加水稀释,以抑制其水解。配制溶液在烧杯中进行,不需要石棉网和坩埚;
(2)SO2与FeCl3溶液发生氧化还原反应,Fe3+被还原为Fe2+,溶液由棕黄色变为浅绿色;
(3)①SO2与FeCl3溶液反应生成硫酸和FeCl2,离子方程式为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②检验Fe2+时要排除Fe3+的干扰,即先加KSCN溶液,在确认溶液中不存在Fe3+的情况下,加入氯水等氧化剂,若有Fe2+,则溶液变红;
③向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,该沉淀可能是硝酸将溶解的SO2氧化为H2SO4,从而生成白色沉淀,所以不合理;
(4)倒置的漏斗与水有较大的接触面积,可使气体充分吸收并防止溶液倒吸;
(5)验证SO2具有还原性,要求用具有氧化性的试剂,能与SO2发生氧化还原反应且有明显现象,答案为bc。

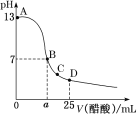
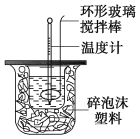
【题目】利用如图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): ______。
(2)倒入NaOH溶液的正确操作是________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ____________________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②上述实验测量结果得出的中和热的数值与57.3 kJ/mol相比偏小,产生的原因可能是(填字母)_________。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
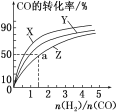
【题目】在一密闭容器中充入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
据此判断下列结论正确的是( )
A.在t3时刻反应已经停止
B.t1~t4时刻,A的转化率比B的转化率低
C.在容器中发生的反应为2A+B![]() 2C
2C
D.增大压强,达平衡时混合气体的平均相对分子质量增大