题目内容
【题目】25℃时,向25mL0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )
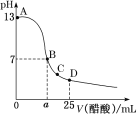
A.在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.用含a的代数式表示CH3COOH的电离常数K=![]()
C.C点对应的溶液中,水电离出的H+浓度大于10-7mol·L-1
D.D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(OH-)-2c(H+)
【答案】B
【解析】
A.在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有: c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),c(H+)<c(OH-),溶液中离子浓度大小关系可能为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),但当加入的醋酸极少量时,c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故A错误;
B. 25℃时B点溶液呈中性,则溶液中c(H+) =10-7molL-1,溶液中存在电荷守恒c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),该点c(H+)=c(OH-),则c(CH3COO-)= c(Na+)=![]() ,此时加入的醋酸过量,所以c(CH3COOH)=
,此时加入的醋酸过量,所以c(CH3COOH)=![]() ,
,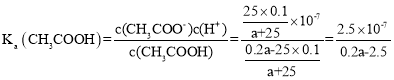 ,故B正确;
,故B正确;
C.C点对应的溶液中,醋酸过量,溶液呈酸性,对水的电离有抑制作用,水电离出的H+浓度小于10-7molL-1,故C错误;
D.D点对应的溶液中溶质为CH3COOH和CH3COONa,且物质的量为1:1,根据物料守恒可知c(CH3COO-)+ c(CH3COOH)=2c(Na+),根据电荷守恒可知c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),两式联立可得c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-),故D错误;
故答案为B。