题目内容
3.150mL稀硫酸与2.7g铝粉恰好反应,计算:(1)生成氢气的体积(标况);
(2)稀硫酸的物质的量浓度.
分析 (1)据题中的反应原理写出硫酸和铝反应的方程式,然后根据题中的铝的质量解出生成的氢气的物质的量和体积;
(2)根据铝的质量求出参加反应的硫酸的物质的量,然后根据c=$\frac{n}{V}$计算硫酸溶液中溶质的物质的量浓度.
解答 解:(1)2.7gAl的物质的量$\frac{2.7g}{27g/mol}$=0.1mol,设产生氢气的物质的量是x,消耗的硫酸的物质的量为y
2Al+3H2SO4═2Al2(SO4)3+3H2↑
2 3 3
0.1mol y x
$\frac{2}{0.1}=\frac{3}{y}=\frac{3}{x}$,解得x=0.15mol,生成氢气的体积=22.4L/mol×0.15mol=3.36L,答:生成氢气的体积(标况)是3.36L;
(2)y=0.15mol,稀硫酸的物质的量浓度=$\frac{0.15mol}{0.15L}$=1mol/L,答:稀硫酸的物质的量浓度是1mol/L.
点评 在解此类题时,首先要分析题中的反应原理,书写方程式,找出比例关系,解出需要的数据.

练习册系列答案
相关题目
13.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 在过氧化钠与水的反应中,每生成1mol氧气,转移电子的数目为1NA | |
| B. | 将0.1mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA | |
| C. | 标准状况下,22.4LCCl4含有NA个CCl4分子 | |
| D. | 1 molOD- 含有的质子、中子数均为9NA |
14.Al、Fe、Cu都是重要而常见的金属,下列有关说法正确的是( )
| A. | 三者的单质在常温下都能溶于浓硫酸和浓硝酸 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 三者所对应的氢氧化物在水中都存在溶解平衡 | |
| D. | 工业上制备这三种金属的方法依次为电解法、热分解法和热还原法 |
11.下列实验过程能引起结果偏高的是( )
| A. | 配制100 g 10% CuSO4溶液,称取10 g硫酸铜晶体溶于90 g水中 | |
| B. | 将30%的乙醇溶液和70%的乙醇溶液等体积混和后所得乙醇溶液的质量分数为50% | |
| C. | 配制一定物质的量浓度的稀硫酸溶液时,称量浓硫酸时仰视量筒的刻度线 | |
| D. | 质量分数为10%和90%的两种硫酸等质量混合配制50%的硫酸溶液 |
18.为了证明甲酸溶液中含有少量甲醛,正确的实验操作是( )
| A. | 加入银氨溶液,在水浴上加热 | |
| B. | 加入二至三滴紫色石蕊试液 | |
| C. | 先蒸馏,然后对蒸出的物质的水溶液进行银镜反应实验 | |
| D. | 先加入足量的NaOH溶液,然后蒸馏,对蒸出的物质的水溶液进行银镜反应实验 |
4.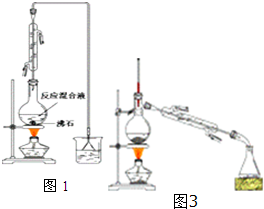 已知:
已知:
根据题意完成填空:
(一)制备1-溴丁烷粗产品:在图1装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O
(1)反应装置中加入沸石的目的是防止液体暴沸.配制体积比为1:1的硫酸所用的定量仪器为b(选填编号)
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为下进上出,这样选择的原因是能更充分冷凝.
(3)图2装置中,能代替上图中最后收集装置的是ABD(填序号).

(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品:将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图3装置蒸馏.(5)收集产品时,控制的温度应在101.6℃左右;
(6)实验制得的1-溴丁烷的质量为10.895g,则正丁醇的产率为72.7%.
 已知:
已知:| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
(一)制备1-溴丁烷粗产品:在图1装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O
(1)反应装置中加入沸石的目的是防止液体暴沸.配制体积比为1:1的硫酸所用的定量仪器为b(选填编号)
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为下进上出,这样选择的原因是能更充分冷凝.
(3)图2装置中,能代替上图中最后收集装置的是ABD(填序号).

(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品:将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图3装置蒸馏.(5)收集产品时,控制的温度应在101.6℃左右;
(6)实验制得的1-溴丁烷的质量为10.895g,则正丁醇的产率为72.7%.
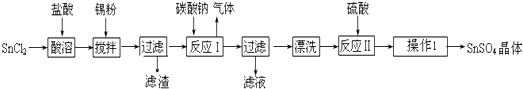
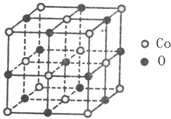 我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.
我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.