题目内容
10.25℃某气态烃与氧气混合充入密闭容器中,点火爆炸后又恢复到25℃,此时容器内压强为开始时的一半,再经氢氧化钠溶液处理,容器内几乎为真空,该烃的分子式为( )| A. | C2H4 | B. | C3H6 | C. | C2H6 | D. | C4H8 |
分析 经氢氧化钠溶液处理后,容器内几乎变为真空,说明气态烷烃和氧气完全反应,设烷烃的分子式为CnH2n+2,点燃爆炸后,又恢复到起始温度,此时容器内的压强减至原压强的一半,剩余气体为CO2,生成的二氧化碳的分子物质的量是烃与氧气总物质的量的一半,根据燃烧的通式进行计算.
解答 解:烃燃烧后的气体经NaOH溶液吸收,容器几乎成真空,说明烃和O2完全反应生成CO2和液态水,
设此碳氢化合物的化学式为CxHy,则有
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,
根据题意可知:1+x+$\frac{y}{4}$=2×x,
整理可得:x=1+$\frac{y}{4}$,y只能为4的倍数,
当y=4时,x=2,
当y=8时,x=3,
当y=12时,x=4,不存在该物质,
故该烃的分子式可能为:C2H4或C3H8,
故选A.
点评 本体考查有机物分子式的确定,题目难度中等,明确反应前后压强的变化含义是解答该题的关键,注意掌握根据烃的燃烧通式进行化学计算的方法.

练习册系列答案
相关题目
18.下表是3种物质的溶解度(20℃),下列说法正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的KSp=6.82×10-6mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将表中三种物质分别与水混合,分别加热、灼烧,最终的固体产物相同 | |
| D. | 用足量石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O |
5.甲烷中混有乙烯,除去乙烯得到纯净的甲烷,最好依次通过盛有哪些试剂的洗气瓶( )
| A. | 澄清的石灰水,浓H2SO4 | B. | 浓H2SO4,溴水 | ||
| C. | 溴水,浓H2SO4 | D. | 浓H2SO4,酸性KMnO4溶液 |
15.下列四组物质,组内每种混合物都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水、酒精和水、植物油和水 | |
| B. | 四氯化碳和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙酸和乙醇、乙酸和水 | |
| D. | 水和植物油、己烷和水、苯和水 |
19.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:下列说法正确的是( )
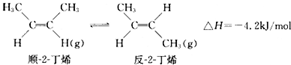

| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 加压和降温都有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯不能使溴水褪色 |
20. “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
 “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法错误的是( )| A. | 甲物质在一定条件下可以生成有机高分子化合物 | |
| B. | 1mol乙物质可与2mol钠完全反应生成1mol氢气 | |
| C. | 甲、丙物质都能使溴的四氯化碳溶液褪色 | |
| D. | 甲在酸性条件下水解产物之一与乙互为同系物 |
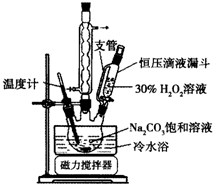 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.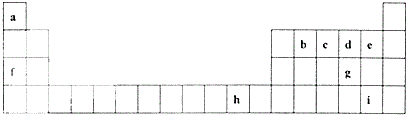 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素. .
.