题目内容
【题目】NiOOH难溶于水,常作电池的正极材料。利用某含镍废料(主要成分为NiO,另含有SiO2、Fe2O3、CuO三种杂质)制备NiOOH的工业流程如图。
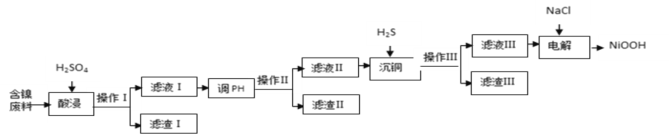
已知:
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | |
开始沉淀的pH | 1.5 | 4.4 | 6.7 |
沉淀完全的pH | 3.7 | 6.9 | 9.2 |
(1)提高酸浸速度的方法为_______________________、_____________________(任写2条)
(2)滤渣Ⅰ的成分为__________;若滤渣Ⅱ为Fe(OH)3,则“调pH”的范围为_____________.
(3)沉铜时发生反应的离子方程式为______________________________________________。
(4)电解过程是控制在碱性条件下阳极产生ClO-,并用ClO-将Ni2+氧化的过程。请写出氧化过程中发生反应的离子方程式____________________________________________________。
【答案】适当提高硫酸的浓度 加热(或搅拌、粉碎含镍废料等)(合理即可) SiO2 3.7≤pH<4.4 H2S + Cu2+ = CuS↓ + 2H+ ClO- + 2Ni2+ +4OH- =2NiOOH +Cl- +H2O
【解析】
含镍废料(主要成分为NiO,另含有SiO2、Fe2O3、CuO三种杂质),用硫酸酸浸,过滤得到含有Ni2+、Fe3+、Cu2+、H+和SO42-的滤液I,滤渣I为SiO2,根据Ni2+、Fe3+、Cu2+沉淀的pH可知,调节滤液I的pH为3.7≤pH<4.4,使Fe3+转化为Fe(OH)3沉淀而过滤除去,滤渣II为Fe(OH)3沉淀,继续在滤液II中通入H2S,使Cu2+转化为CuS沉淀而过滤除去,滤渣III为CuS沉淀,滤液III中含有Ni2+,在滤液III中加入NaCl,电解得到NiOOH,据此分析解答。
(1)提高酸浸速度的方法为适当提高硫酸的浓度、加热、搅拌或粉碎含镍废料等;故答案为:适当提高硫酸的浓度;加热(或搅拌、粉碎含镍废料等)(合理即可);
(2)含镍废料(主要成分为NiO,另含有SiO2、Fe2O3、CuO三种杂质),用硫酸酸浸,只有SiO2不与硫酸反应,则滤渣I为SiO2;根据Ni2+、Fe3+、Cu2+沉淀的pH可知,若滤渣Ⅱ为Fe(OH)3,则“调pH”的范围为3.7≤pH<4.4,故答案为:SiO2;3.7≤pH<4.4;
(3)通入H2S,使Cu2+转化为CuS沉淀而过滤除去,故沉铜时发生反应的离子方程式为H2S + Cu2+= CuS↓ + 2H+,故答案为:H2S + Cu2+ = CuS↓ + 2H+;
(4)电解过程是控制在碱性条件下,阳极产生ClO-,并用ClO-将Ni2+氧化的过程,ClO-得电子被还原为Cl-,Ni2+失电子被氧化为NiOOH,则该氧化过程中发生反应的离子方程式为ClO- + 2Ni2+ +4OH- =2NiOOH +Cl- +H2O,故答案为:ClO- + 2Ni2+ +4OH- =2NiOOH +Cl- +H2O。