题目内容
【题目】已知:X(g)+2Y(g) ![]() 3Z(g)△H=-akJmol﹣1(a>0)。下列说法不正确的是
3Z(g)△H=-akJmol﹣1(a>0)。下列说法不正确的是
A.升高反应温度,逆反应速率增大,正反应速率减小
B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C.1molX和2molY完全反应生成3mol的Z,放出akJ的热量
D.0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
【答案】A
【解析】
A.升高反应温度,活化分子百分数增大,则正逆反应速率均增大,故A错误;
B.化学平衡时正逆反应速率相等,体系中各组分的浓度不变,所以达到化学平衡状态时,X、Y、Z的浓度不再发生变化,故B正确;
C.因为热化学方程式的意义是热化学方程式不仅表明了一个反应中的反应物和生成物,还表明了一定量物质在反应中所放出或吸收的热量,对于X(g)+2Y(g) ![]() 3Z(g)△H=-akJmol﹣1(a>0),我们就读作1molX和2molY完全反应生成3molZ,放出akJ的热量,故C正确;
3Z(g)△H=-akJmol﹣1(a>0),我们就读作1molX和2molY完全反应生成3molZ,放出akJ的热量,故C正确;
D.可逆反应不可能完全转化,所以0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol,故D正确;
答案为A。

 每日10分钟口算心算速算天天练系列答案
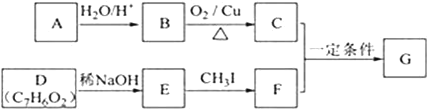
每日10分钟口算心算速算天天练系列答案【题目】NiOOH难溶于水,常作电池的正极材料。利用某含镍废料(主要成分为NiO,另含有SiO2、Fe2O3、CuO三种杂质)制备NiOOH的工业流程如图。
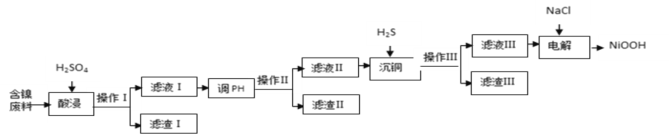
已知:
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | |
开始沉淀的pH | 1.5 | 4.4 | 6.7 |
沉淀完全的pH | 3.7 | 6.9 | 9.2 |
(1)提高酸浸速度的方法为_______________________、_____________________(任写2条)
(2)滤渣Ⅰ的成分为__________;若滤渣Ⅱ为Fe(OH)3,则“调pH”的范围为_____________.
(3)沉铜时发生反应的离子方程式为______________________________________________。
(4)电解过程是控制在碱性条件下阳极产生ClO-,并用ClO-将Ni2+氧化的过程。请写出氧化过程中发生反应的离子方程式____________________________________________________。