题目内容
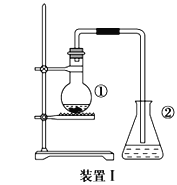
【题目】某化学实验小组同学利用以下实验装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:
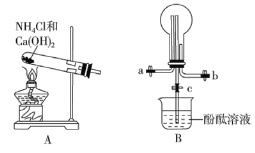
(1)实验室制备氨气的化学方程式为_________。
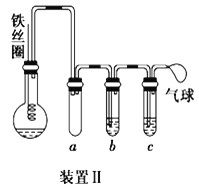
(2)用装置 B 收集氨气时,应选择氨气的进气口是_________ (选填“a”或“b”),并说明选择的理由是_________。
(3)打开装置B 中的止水夹 c,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是_____,请用方程式表示:_______________________________;氨气催化氧化可用于制硝酸,请写出氨气催化氧化的化学方程式 _______________________________ 。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_______ (填序号)。

(5)SiO2 在自然界中广泛存在,它是制备现代通讯材料________ (写该材料名称)的主要原料;以 SiO2 为原料, 在工业上制备单质硅的化学方程式为________
【答案】2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O a 氨气的密度小于空气的密度 氨极易溶于水,氨水显碱性 NH3+H2O
2NH3↑+CaCl2+2H2O a 氨气的密度小于空气的密度 氨极易溶于水,氨水显碱性 NH3+H2O![]() NH 3﹒H 2O
NH 3﹒H 2O![]()
![]() +OH- 4NH3+5O2
+OH- 4NH3+5O2![]() 4NO+6H2O ②④ 光导纤维 2C+SiO2
4NO+6H2O ②④ 光导纤维 2C+SiO2![]() Si+2CO↑
Si+2CO↑
【解析】
本实验利用氯化铵和氢氧化钙混合加热制取氨气,氨气极易溶于水,利用这一条性质选择合适的收集装置和尾气处理装置;氨气的喷泉实验中,进入烧瓶中的液体变成红色说明氨水显碱性,据此回答。
(1)实验室制备氨气,用NH4Cl固体和Ca(OH)2固体受热产生,反应方程式为:2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O;
(2)因为氨气的密度小于空气,采用向下排空气法收集,因此从a口进入;
(3)烧瓶内产生了红色喷泉,说明氨气极易溶于水且氨水显碱性,使酚酞变红,这一过程的化学方程式为NH3+H2O![]() NH3·H2O
NH3·H2O![]()
![]() +OH-;氨气催化氧化可用于制硝酸,氨气经催化氧化后生成NO,NO与氧气反应生成NO2,NO2溶于水生成硝酸,则氨气催化氧化的化学方程式为4NH3+5O2
+OH-;氨气催化氧化可用于制硝酸,氨气经催化氧化后生成NO,NO与氧气反应生成NO2,NO2溶于水生成硝酸,则氨气催化氧化的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(4)氨气极易溶于水,防止倒吸,因此需要倒置的漏斗或干燥管,故②④正确;
(5)SiO2广泛存在自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅;碳能与二氧化硅反应生成硅单质,化学反应方程式:SiO2+2C![]() Si+2CO↑。
Si+2CO↑。

 名题金卷系列答案
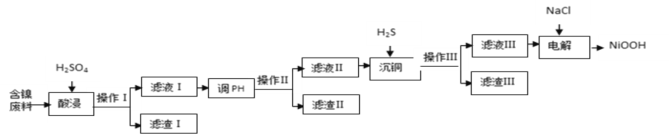
名题金卷系列答案【题目】NiOOH难溶于水,常作电池的正极材料。利用某含镍废料(主要成分为NiO,另含有SiO2、Fe2O3、CuO三种杂质)制备NiOOH的工业流程如图。
已知:
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | |
开始沉淀的pH | 1.5 | 4.4 | 6.7 |
沉淀完全的pH | 3.7 | 6.9 | 9.2 |
(1)提高酸浸速度的方法为_______________________、_____________________(任写2条)
(2)滤渣Ⅰ的成分为__________;若滤渣Ⅱ为Fe(OH)3,则“调pH”的范围为_____________.
(3)沉铜时发生反应的离子方程式为______________________________________________。
(4)电解过程是控制在碱性条件下阳极产生ClO-,并用ClO-将Ni2+氧化的过程。请写出氧化过程中发生反应的离子方程式____________________________________________________。