题目内容
【题目】在一个固定容积的密闭容器中通入amolN2与bmolH2的混合气体,保持温度不变,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)若反应到某时刻t时,n(N2)=9mol,n(NH3)=2mol,则a=____mol;
(2)反应达平衡时,混合气体的体积为448L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量____;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平)=____;
(4)原混合气体中,a∶b=_____;
(5)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=_____。
【答案】10 5mol 5:4 2:3 3:3:2
【解析】
(1)根据题意列三段式有:
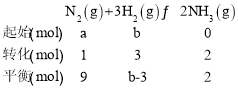
根据三段式可知a=(9+1)mol=10mol;
(2)混合气体的体积为448L(标况下),则混合气体的物质的量为![]() =20mol,NH3的含量(体积分数)为25%,体积分数即物质的量分数,所以n(NH3)=20mol×25%=5mol;
=20mol,NH3的含量(体积分数)为25%,体积分数即物质的量分数,所以n(NH3)=20mol×25%=5mol;
(3)平衡时n(NH3)=5mol,列三段式有

则有(7.5+b-7.5+5)mol=20mol,解得b=15mol,则初始时气体的总物质的量为25mol,所以n(始)∶n(平)=25:20=5:4;
(4)根据2、3小题可知a=10mol,b=15mol,a:b=10:15=2:3;
(5)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=7.5:7.5:5=3:3:2。

【题目】短周期主族元素A、B、C、D、E原子序数依次增大。A、E同主族,E原子最外层上的电子数是D原子最外层电子数的4倍,D离子与C2-具有相同核外电子排布。

试回答下列问题:
(1)元素E在元素周期表中的位置是______。
(2)A和E最高价氧化物对应的水化物,酸性较弱的为_____。若用图中装置验证这两种酸的酸性强弱,则在仪器P中加入的试剂为_____,Q中观察到的实验现象是_____。
(3)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有_____。
②b与c反应的化学方程式为_____。
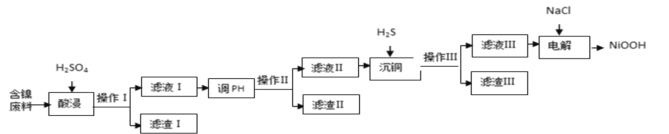
【题目】NiOOH难溶于水,常作电池的正极材料。利用某含镍废料(主要成分为NiO,另含有SiO2、Fe2O3、CuO三种杂质)制备NiOOH的工业流程如图。
已知:
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | |
开始沉淀的pH | 1.5 | 4.4 | 6.7 |
沉淀完全的pH | 3.7 | 6.9 | 9.2 |
(1)提高酸浸速度的方法为_______________________、_____________________(任写2条)
(2)滤渣Ⅰ的成分为__________;若滤渣Ⅱ为Fe(OH)3,则“调pH”的范围为_____________.
(3)沉铜时发生反应的离子方程式为______________________________________________。
(4)电解过程是控制在碱性条件下阳极产生ClO-,并用ClO-将Ni2+氧化的过程。请写出氧化过程中发生反应的离子方程式____________________________________________________。