题目内容
4. 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A. | A是反应物,B、C是生成物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 前2 min C的生成速率为0.05 mol•L-1•min-1 | |
| D. | 反应的方程式为:2A(g)=2B(g)+C(g) |
分析 根据图片知,反应在到达平衡之前,随着反应的进行A的浓度降低、B和C的浓度升高,则A是反应物、B和C是生成物,到达平衡状态时△c(A)=(0.4-0.2)mol/L=0.2mol/L、△c(B)=(0.3-0.1)mol/L=0.2mol/L、△c(C)=(0.1-0)mol/L=0.1mol/L,同一可逆反应同一时间段内,各物质的浓度变化量之比等于其计量数之比,所以A、B、C的计量数之比=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,再结合反应v=$\frac{△c}{△t}$进行计算.
解答 解:A.根据图片知,反应在到达平衡之前,随着反应的进行A的浓度降低、B和C的浓度升高,则A是反应物、B和C是生成物,故A不选;
B.前2 min A的分解速率=$\frac{0.4-0.2}{2}$mol•L-1•min-1=0.1 mol•L-1•min-1,故B不选;
C.前2 min C的生成速率=$\frac{0.1-0}{2}$mol•L-1•min-1=0.05 mol•L-1•min-1,故C不选;
D.到达平衡状态时△c(A)=(0.4-0.2)mol/L=0.2mol/L、△c(B)=(0.3-0.1)mol/L=0.2mol/L、△c(C)=(0.1-0)mol/L=0.1mol/L,同一可逆反应同一时间段内,各物质的浓度变化量之比等于其计量数之比,所以A、B、C的计量数之比=0.2mol/L:0.2mol/L:0.1mol/L=2:2:1,该反应方程式为2A=2B+C,
但不能确定三种物质状态,故D错误;
故选D.
点评 本题以图象分析为载体考查可逆反应的有关计算,侧重考查学生分析计算能力,正确获取信息、加工和利用信息是解本题关键,易错选项是D,题目难度中等.

| A. | 一定增重64g | B. | 一定减重64g | ||
| C. | 可能增重64g,也可能减重64g | D. | 既不增重也不减重 |
| A. | C5H10 | B. | C4H10 | C. | CH2Cl2 | D. | C2H4Cl2 |
| A. | AgNO3(AgNO3) | B. | NaOH(NaOH) | C. | KCl(KCl) | D. | CuSO4(CuO) |
| A. | OH- | B. | 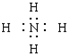 | C. | 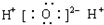 | D. |  |
| A. | 防止电池中汞、镉和铅等重金属离子污染土壤和水源 | |
| B. | 回收利用石墨电极和金属材料 | |
| C. | 充电后可再使用 | |
| D. | 防止电池中的电解质溶液腐蚀其他物品 |