题目内容
15.某化学兴趣小组的同学设计了如图所示的装置,完成下列问题.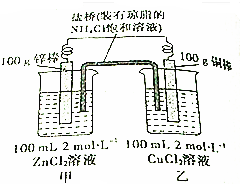
(1)反应过程中,锌棒质量减少;
(2)正极的电极反应式为Cu2++2e-=Cu;
(3)反应过程中,当一电极质量增加2g,另一电极减轻的质量大于(填“大于”、“小于”或“等于”)2g.
分析 锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,结合电极方程式解答该题.
解答 解:(1)锌为负极,被氧化,则锌棒质量减小,故答案为:锌;
(2)铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)反应过程中,当一电极质量增加2g,应为正极,则转移电子的物质的量为$\frac{2}{64}×2$mol=$\frac{1}{16}$mol,负极质量减少$\frac{1}{16}×65$×$\frac{1}{2}$>2,故答案为:大于.
点评 本题考查了原电池原理和电极反应式的书写,为高频考点,侧重于学生的分析能力的考查,难度不大,注意把握原电池的工作原理.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
5.喷水溶液法是科学家近期研制出的一种使沙漠变绿洲的新技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯 (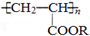 )“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下一定深度处形成一个一定厚度的隔水层,既能阻止地下盐分的上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法正确的是( )
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下一定深度处形成一个一定厚度的隔水层,既能阻止地下盐分的上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法正确的是( )
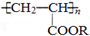 )“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下一定深度处形成一个一定厚度的隔水层,既能阻止地下盐分的上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法正确的是( )
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下一定深度处形成一个一定厚度的隔水层,既能阻止地下盐分的上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法正确的是( )| A. | 聚丙烯酸酯是混合物,没有固定的熔沸点 | |
| B. | 聚丙烯酸酯不能发生取代反应 | |
| C. | 聚丙烯酸酯和其单体(单体的结构式为CH2=CHCOOR)都能发生加成反应 | |
| D. | 合成聚丙烯酸酯的反应属于消去反应 |
3.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 维生素C可用于治疗胃酸过多 | |
| B. | 加入Na2S可消除污水中的污染Hg2+ | |
| C. | 利用太阳能等清洁能源有利于保护环境 | |
| D. | 开发废电池的综合利用技术有利于防止污染土壤 |
10.草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
[查阅资料]KMnO4溶液氧化H2C2O4的反应历程为:
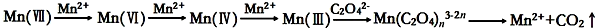
[提出假设]
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是反应物浓度降低,反应速率减慢.
[设计、完成实验]
(1)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL0.10mol/L H2C2O4溶液.
①在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶.
②下列操作会使所配溶液浓度偏低的是AD(填下列选项的字母序号).
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
x=25时,假设2成立.
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定.取10.00mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.上述实验中KMnO4溶液的物质的量浓度为0.010mol/L.
[查阅资料]KMnO4溶液氧化H2C2O4的反应历程为:
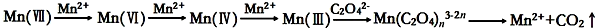
[提出假设]
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是反应物浓度降低,反应速率减慢.
[设计、完成实验]
(1)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL0.10mol/L H2C2O4溶液.
①在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶.
②下列操作会使所配溶液浓度偏低的是AD(填下列选项的字母序号).
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
| 实验编号 | 烧杯中所加试剂及用量(mL) | 控制 条件 | 溶液褪色时间(S) | |||
| 0.10mol/LH2C2O4 溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65° | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL0.10mol/LK2SO4 | 18 |
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定.取10.00mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.上述实验中KMnO4溶液的物质的量浓度为0.010mol/L.
20.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径:A>B>C>D | |
| B. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| C. | 原子序数:b>a>c>d | |
| D. | 金属性:B>A,气态氢化物稳定性:D>C |
7.放射性元素钚(Pu)有20种放射性同位素,下列关于${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu的说法正确的是( )
| A. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu都含有94个中子 | |
| B. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu互为同位素 | |
| C. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu的核外电子数不同 | |
| D. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu分别含有146和147个质子 |
4. 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A. | A是反应物,B、C是生成物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 前2 min C的生成速率为0.05 mol•L-1•min-1 | |
| D. | 反应的方程式为:2A(g)=2B(g)+C(g) |
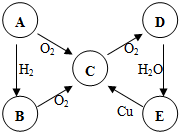 ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式)
ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式) B→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
B→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.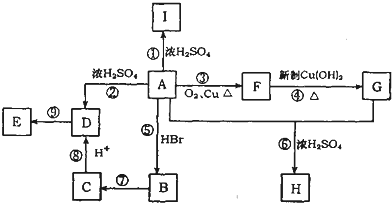
 .
. ;写出反应⑦的化学方程式:
;写出反应⑦的化学方程式: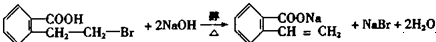 .
.