题目内容
13.(1)写出实验室制乙烯的化学方程式C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O(2)该实验需加入碎瓷片目的是防暴沸
(3)下列实验操作正确的是CD
A、配制乙醇与浓硫酸的混合液时,将1体积乙醇沿烧杯器壁缓缓注入3体积的浓硫酸中,并用玻璃棒不断搅拌
B、加热混合液时,应小心加热使温度缓缓上升至所需温度
C、温度计水银球的位置应伸入液面之下,而不是液面之上
D、收集乙烯气体时应用排水法收集,不能用排空气法收集
(4)写出加热条件下溴乙烷与NaOH的水溶液反应的化学方程式:CH3CH2Br+NaOH$\stackrel{△}{→}$CH3CH2OH+NaBr.
分析 (1)乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯;
(2)为防止发生爆沸,应加入几块碎瓷片;
(3)A.依据浓硫酸稀释正确方法解答;
B.反应应迅速升温到170度,否则容易引人副产物;
C.温度计测量液体温度;
D.依据密度与空气密度接近,不能用排空气法收集,乙烯难溶于水,可选择排水法收集;
(4)溴乙烷在碱性溶液中加热发生取代反应生成乙醇.
解答 解:(1)乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯,方程式:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O;
故答案为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O;
(2)加热乙醇浓硫酸混合溶液容易发生爆沸,加入碎瓷片可以防止爆沸;
故答案为:防爆沸;
(3)A.配制乙醇与浓硫酸的混合液时,应将乙醇沿着烧杯壁缓缓注入乙醇中,并不断搅拌,使产生的热量迅速散失,防止液体飞溅伤人,故A错误;
B.乙醇在140度容易反应生成乙醚,为减少副产物,应迅速升高温度到170度,故B错误;
C.温度计测量液体温度,应插入液面以下,故C正确;
D.乙烯密度与空气密度相差不大,难溶于水,应选择排水法收集,故D正确;
故选:CD;
(4)溴乙烷在碱性溶液中加热发生取代反应生成乙醇,反应的方程式:CH3CH2Br+NaOH $\stackrel{△}{→}$CH3CH2OH+NaBr;
故答案为:CH3CH2Br+NaOH $\stackrel{△}{→}$CH3CH2OH+NaBr.
点评 本题考查了乙烯的实验室制备,明确反应原理是解题关键,注意反应条件应迅速升高到170度,题目难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
3.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 维生素C可用于治疗胃酸过多 | |
| B. | 加入Na2S可消除污水中的污染Hg2+ | |
| C. | 利用太阳能等清洁能源有利于保护环境 | |
| D. | 开发废电池的综合利用技术有利于防止污染土壤 |
4. 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A. | A是反应物,B、C是生成物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 前2 min C的生成速率为0.05 mol•L-1•min-1 | |
| D. | 反应的方程式为:2A(g)=2B(g)+C(g) |
8.用下图所示装置及药品进行相应实验,能达到实验目的是( )
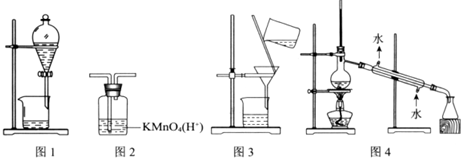

| A. | 图1 分离乙醇和乙酸 | B. | 图2 除去乙炔中的乙烯 | ||
| C. | 图3 除去溴苯中的溴单质 | D. | 图4 除去工业酒精中的甲醇 |
18.在通常状况下,下列气体能共存且能用碱石灰干燥的一组是( )
| A. | O2、NH3、HCl | B. | O2、NO、NO2 | C. | O2、H2、N2 | D. | CO2、H2、SO2 |
2.常温下,下列各组物质相混合不能产生气体的是( )
| A. | 铁与浓硫酸 | B. | 铁与稀硫酸 | ||
| C. | 铝与氢氧化钠溶液 | D. | 大理石与盐酸 |
12.经研究发现家蚕的信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3,白蚁信息素有: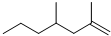 (甲) 和
(甲) 和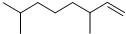 (乙).下列说法不正确的是( )
(乙).下列说法不正确的是( )
 (甲) 和
(甲) 和 (乙).下列说法不正确的是( )
(乙).下列说法不正确的是( )| A. | 家蚕信息素与1molBr2加成产物只有两种 | |
| B. | 以上三种信息素均能使溴水溶液褪色 | |
| C. | 白蚁信息素甲与乙互为同系物 | |
| D. | 家蚕信息素的加聚产物能使酸性KMnO4溶液褪色 |

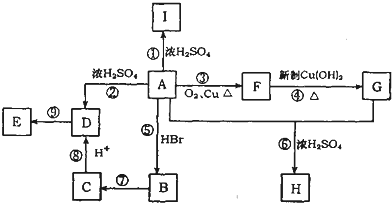
 .
. ;写出反应⑦的化学方程式:
;写出反应⑦的化学方程式: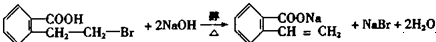 .
.