题目内容
14.如图原电池装置,当装置电路中通过2mol电子时,Cu电极( )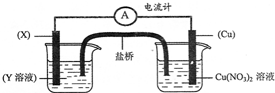
| A. | 一定增重64g | B. | 一定减重64g | ||
| C. | 可能增重64g,也可能减重64g | D. | 既不增重也不减重 |
分析 该原电池装置中铜电极可以做负极溶解,也可以做正极,溶液中铜离子在铜上析出铜,据此分析.
解答 解:当装置②电路中通过2mol电子时,依据电子守恒计算,X为Zn,Y为硫酸锌时,Cu电极做正极电极质量增重64g,X为Ag,Y为硝酸银时,铜电极做负极电极质量减重64g,故选C.
点评 本题考查了原电池原理,注意负极是相对活泼的金属,负极发生氧化反应,正极发生还原反应,题目难度不大.

练习册系列答案
相关题目
4. 只用如图装置(省略夹持装置和净化装置)和表中提供的物质就能完成实验室某些物质(X)的制备实验,其中最合理的是( )
只用如图装置(省略夹持装置和净化装置)和表中提供的物质就能完成实验室某些物质(X)的制备实验,其中最合理的是( )
 只用如图装置(省略夹持装置和净化装置)和表中提供的物质就能完成实验室某些物质(X)的制备实验,其中最合理的是( )
只用如图装置(省略夹持装置和净化装置)和表中提供的物质就能完成实验室某些物质(X)的制备实验,其中最合理的是( )| 选项 | a中的物质 | b中的物质 | c中的物质 | d中的物质 | X中的物质 |
| A | 浓硝酸 | Fe | 稀盐酸 | Na2S | H2SO4 |
| B | 稀硫酸 | Zn | 浓盐酸 | MnO2 | HCl |
| C | 浓硫酸 | C2H5OH | 溴单质 | CCl4 | CH2BrCH2Br |
| D | 浓硫酸 | 浓盐酸 | 浓氨水 | CaO | NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
5.喷水溶液法是科学家近期研制出的一种使沙漠变绿洲的新技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯 (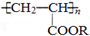 )“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下一定深度处形成一个一定厚度的隔水层,既能阻止地下盐分的上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法正确的是( )
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下一定深度处形成一个一定厚度的隔水层,既能阻止地下盐分的上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法正确的是( )
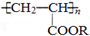 )“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下一定深度处形成一个一定厚度的隔水层,既能阻止地下盐分的上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法正确的是( )
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下一定深度处形成一个一定厚度的隔水层,既能阻止地下盐分的上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法正确的是( )| A. | 聚丙烯酸酯是混合物,没有固定的熔沸点 | |
| B. | 聚丙烯酸酯不能发生取代反应 | |
| C. | 聚丙烯酸酯和其单体(单体的结构式为CH2=CHCOOR)都能发生加成反应 | |
| D. | 合成聚丙烯酸酯的反应属于消去反应 |
2.硫酸是重要的化工产品,目前主要采用“接触法”进行生产.有关接触氧化反应2SO2+O2?2SO3(该反应为放热反应)的说法中正确的是( )
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 | |
| C. | 温度越高反应速率越快,平衡时生成的SO3越多 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
9.有机物X由C、H、O三种元素组成,相对分子质量为90,分子中含有3个氧原子,能与NaHCO3溶液反应生成CO2.在浓硫酸作用下,2分子A之间脱水可生成六元环化合物.有关X的说法正确的是( )
| A. | 分子式是C3H8O3 | |
| B. | A催化氧化的产物能发生银镜反应 | |
| C. | 0.1 mol A与足量Na反应产生2.24 L H2(标准状况) | |
| D. | A在一定条件下发生缩聚反应的产物是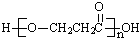 |
19.有A、L、Z、W、Q五种短周期元素,其中Z、Q同主族,A、L、Z、W同周期;A+与Q2-具有相同的电子层结构; L的单质晶体熔点高、硬度大,是一种重要的半导体材料;离子半径:Z2->W-.下列说法中,正确的是( )
| A. | 元素L、Z、W的单质晶体属于同种类型的晶体 | |
| B. | 由于W、Z、Q元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| C. | A、Q两种元素能形成A2Q和A2Q2型化合物 | |
| D. | 元素W和Q的某些单质不可以作为水处理中的消毒剂 |
3.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 维生素C可用于治疗胃酸过多 | |
| B. | 加入Na2S可消除污水中的污染Hg2+ | |
| C. | 利用太阳能等清洁能源有利于保护环境 | |
| D. | 开发废电池的综合利用技术有利于防止污染土壤 |
4. 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A. | A是反应物,B、C是生成物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 前2 min C的生成速率为0.05 mol•L-1•min-1 | |
| D. | 反应的方程式为:2A(g)=2B(g)+C(g) |
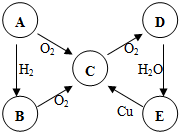 ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式)
ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式) B→C的化学方程式为4NH3+5O2
B→C的化学方程式为4NH3+5O2