题目内容
3.实验室可用NaClO3制取ClO2气体,再由ClO2 制得NaClO2,实验装置如图所示,回答下列问题: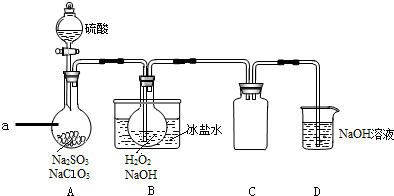
(1)实验容器a称为分液漏斗,B中H2O2发生氧化反应(填“氧化”、“还原”)
(2)实验装置C的作用是防倒吸.
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意控制硫酸滴入速度.
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,则另一种为ClO3-,.
(5)B中反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2.
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入②(填序号,下同)酸化,再加入⑤⑥检验.
①稀HNO3 ②稀H2SO4 ③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9 g NaClO2•3H2O(式量:144.5),至少需26.6g NaClO3(式量:106.5).
分析 用NaClO3制取ClO2气体,再由ClO2 制得NaClO2,由实验装置可知,装置A中盛放硫酸、NaClO3和Na2SO3,反应生成ClO2气体,ClO2气体和H2O2在B发生发生反应,反应能使装置内压强降低,可能发生倒吸,装置C为防倒吸装置,装置D为尾气吸收装置;
(1)仪器a为分液漏斗;B中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应制得NaClO2,二氧化氯中Cl为+4价,变为NaClO2中的+3价,化合价变低,过氧化氢中的元素化合价应该升高,发生氧化反应;
(2)装置C为防止倒吸装置;
(3)缓慢通入ClO2可以使ClO2气体能被均匀、充分吸收;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,根据氧化还原反应规律来书写;
(5)B中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应生成NaClO2,O2和H2O;
(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可;
(7)根据元素守恒进行计算即可.
解答 解:实验过程分析:装置A中盛放硫酸、NaClO3和Na2SO3,反应生成ClO2气体:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O,ClO2气体和H2O2在B发生发生氧化还原反应:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2,发生反应可能使装置内压强降低,可能发生倒吸,装置C为防倒吸装置,装置D为尾气吸收装置;
(1)仪器a为分液漏斗;B中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应制得NaClO2,二氧化氯中Cl为+4价,变为NaClO2中的+3价,化合价变低,过氧化氢中的元素化合价应该升高,发生氧化反应;
故答案为:分液漏斗;氧化;
(2)亚硫酸钠具有还原性,在反应中作还原剂;装置A中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,ClO2进入装置B,发生反应使装置内压强降低,可能发生倒吸,装置C的作用为防止倒吸;
故答案为:防止倒吸;
(3)缓慢通入ClO2,可以使ClO2气体被均匀、充分吸收,ClO2是硫酸、NaClO3与亚硫酸钠反应生成的,所以要使ClO2气体能被均匀、充分吸收,应该控制控制硫酸滴入速度;
故答案为:控制硫酸滴入速度;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-;
故答案为:ClO3-;
(5)B中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应制得NaClO2,二氧化氯中Cl为+4价,变为NaClO2中的+3价,化合价变低,过氧化氢中的元素化合价应该升高,则H2O2中O元素化合价由-2价变为0价,产物为O2和H2O,反应的离子方程式为:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2;
故答案为:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2;
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入非氧化性酸酸化,再加入含Fe2+的化合物,若有Fe3+生成,则证明NaClO2具有氧化性,用KSCN溶液检验Fe3+,现象是溶液变红;
故答案为:②;⑤⑥;
(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可,但是硝酸具有氧化性,会将亚铁离子氧化,所以用硫酸酸化但是不用硝酸酸化,故答案为:②;⑤⑥;
(7)28.9 g NaClO2•3H2O(式量:144.5),n(NaClO2•3H2O)=$\frac{m}{M}$=$\frac{28.9g}{144.5g/mol}$=0.2mol,根据氯原子守恒知:n(NaClO3)=n(NaClO2•3H2O)=0.2mol,m(NaClO3)=n(NaClO3)•M(NaClO3)=0.2mol×106.5g/mol=21.3g;NaClO3转化为NaClO2的转化率为80%,需所要NaClO3的质量为$\frac{21.3g}{80%}$≈26.6g;
故答案为:26.6.
点评 本题是一道化工生产过程中的工艺流程为载体的实验题,需要把握住工艺流程的过程,找到解决问题的突破口,运用基本知识、结合最终要得到的产品来解决,要将教材所学到的基本知识应用到实际解决问题中去,要求基础知识掌握牢固,同时又能将基础知识应用实际应用中.

 口算题天天练系列答案
口算题天天练系列答案 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A. | A是反应物,B、C是生成物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 前2 min C的生成速率为0.05 mol•L-1•min-1 | |
| D. | 反应的方程式为:2A(g)=2B(g)+C(g) |
| A. | 铁与浓硫酸 | B. | 铁与稀硫酸 | ||
| C. | 铝与氢氧化钠溶液 | D. | 大理石与盐酸 |
 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | 图中x点的坐标为(100,6) | |
| C. | 若升高温度,图象会发生变化 | |
| D. | 把0.1mol•L-1的NaCl换成0.1mol•L-1 NaI则图象在终点后变为虚线部分 |
①NaHCO3 ②Al2O3③NH4HSO3 ④Al.
| A. | ③④ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
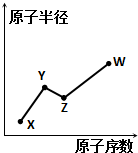 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | Y、W的最简单氢化物的水溶液能相互反应 | |
| C. | X、W可形成离子化合物XW | |
| D. | X、Z、W形成的化合物均为强酸 |
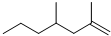 (甲) 和
(甲) 和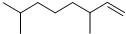 (乙).下列说法不正确的是( )
(乙).下列说法不正确的是( )| A. | 家蚕信息素与1molBr2加成产物只有两种 | |
| B. | 以上三种信息素均能使溴水溶液褪色 | |
| C. | 白蚁信息素甲与乙互为同系物 | |
| D. | 家蚕信息素的加聚产物能使酸性KMnO4溶液褪色 |
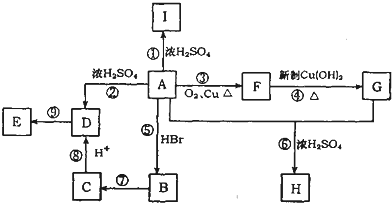
 .
. ;写出反应⑦的化学方程式:
;写出反应⑦的化学方程式: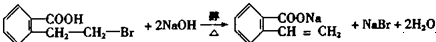 .
.