题目内容
9.下列电子式书写正确的是( )| A. | OH- | B. | 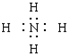 | C. | 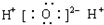 | D. |  |
分析 A.OH-为带1个负电荷的阴离子,需要标出离子中各原子最外层电子;
B.NH4+是多原子构成的阳离子,电子式要加中括号和电荷;
C.水为共价化合物,无阴阳离子,氧原子最外层8个电子,分子中存在两个氧氢键;
D.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷.
解答 解:A.氢氧根离子为带有1个单位负电荷的阴离子,需要标出离子中各原子最外层电子,氢氧根离子的电子式为: ,故A错误;
,故A错误;
B.NH4+是多原子构成的阳离子,电子式要加中括号和电荷,其电子式为: ,故B错误;
,故B错误;
C.水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,故C错误;
,故C错误;
D.氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法,本题难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.有A、L、Z、W、Q五种短周期元素,其中Z、Q同主族,A、L、Z、W同周期;A+与Q2-具有相同的电子层结构; L的单质晶体熔点高、硬度大,是一种重要的半导体材料;离子半径:Z2->W-.下列说法中,正确的是( )
| A. | 元素L、Z、W的单质晶体属于同种类型的晶体 | |
| B. | 由于W、Z、Q元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| C. | A、Q两种元素能形成A2Q和A2Q2型化合物 | |
| D. | 元素W和Q的某些单质不可以作为水处理中的消毒剂 |
20.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径:A>B>C>D | |
| B. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| C. | 原子序数:b>a>c>d | |
| D. | 金属性:B>A,气态氢化物稳定性:D>C |
4. 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A. | A是反应物,B、C是生成物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 前2 min C的生成速率为0.05 mol•L-1•min-1 | |
| D. | 反应的方程式为:2A(g)=2B(g)+C(g) |
18.在通常状况下,下列气体能共存且能用碱石灰干燥的一组是( )
| A. | O2、NH3、HCl | B. | O2、NO、NO2 | C. | O2、H2、N2 | D. | CO2、H2、SO2 |
8.下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应,组合最全面的是( )
①NaHCO3 ②Al2O3③NH4HSO3 ④Al.
①NaHCO3 ②Al2O3③NH4HSO3 ④Al.
| A. | ③④ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
