题目内容
12.下列分子式表示的物质一定是纯净物的是( )| A. | C5H10 | B. | C4H10 | C. | CH2Cl2 | D. | C2H4Cl2 |
分析 同分异构体是分子式相同,但结构不同的化合物;根据是否存在同分异构体判断正误.
解答 解:A.C5H10可以表示1-戊烯和2-戊烯等物质,存在同分异构体,不是纯净物,故A错误;
B.C4H10可以表示正丁烷和异丁烷物质,存在同分异构体,不是纯净物,故B错误;
C.CH2Cl2只有一种结构,不存在同分异构体,是纯净物,故C正确;
D.C2H4Cl2有CHCl2CH3和CH2ClCH2Cl两种同分异构体,不是纯净物,故D错误.
故选C.
点评 本题以纯净物为载体考查了同分异构现象,难度不大,注意纯净物必须是由同一种物质组成.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.硫酸是重要的化工产品,目前主要采用“接触法”进行生产.有关接触氧化反应2SO2+O2?2SO3(该反应为放热反应)的说法中正确的是( )
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 | |
| C. | 温度越高反应速率越快,平衡时生成的SO3越多 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
3.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 维生素C可用于治疗胃酸过多 | |
| B. | 加入Na2S可消除污水中的污染Hg2+ | |
| C. | 利用太阳能等清洁能源有利于保护环境 | |
| D. | 开发废电池的综合利用技术有利于防止污染土壤 |
20.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径:A>B>C>D | |
| B. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| C. | 原子序数:b>a>c>d | |
| D. | 金属性:B>A,气态氢化物稳定性:D>C |
7.放射性元素钚(Pu)有20种放射性同位素,下列关于${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu的说法正确的是( )
| A. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu都含有94个中子 | |
| B. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu互为同位素 | |
| C. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu的核外电子数不同 | |
| D. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu分别含有146和147个质子 |
4.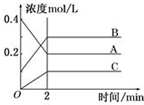 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A. | A是反应物,B、C是生成物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 前2 min C的生成速率为0.05 mol•L-1•min-1 | |
| D. | 反应的方程式为:2A(g)=2B(g)+C(g) |
2.常温下,下列各组物质相混合不能产生气体的是( )
| A. | 铁与浓硫酸 | B. | 铁与稀硫酸 | ||
| C. | 铝与氢氧化钠溶液 | D. | 大理石与盐酸 |