题目内容
9.如图是元素周期表的一部分,根据①~⑧在周期表中的位置,请回答下列问题(请用具体的元素符号及化学用语作答)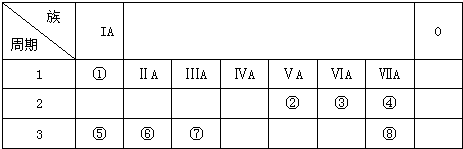
(1)在元素 ①~⑧中,非金属性最强的元素是F(填元素符号),请写出其原子结构示意图
 .
.(2)元素⑤⑥⑦的最高价氧化物对应水化物,按碱性从强到弱的排列顺序是NaOH>Mg(OH)2>Al(OH)3(用化学式表示).
(3)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质.人们在周期表里金属和非金属的交界处找到了半导体材料.
①下列单质中,只有一种物质不能做半导体材料,该物质是C
A.Si B.Ge C.S
②Ga在周期表第ⅢA,As在周期表第ⅤA,但是Ga和As可以形成一种新型化合物半导体材料,其性能比硅更优越.这种新型化合物的化学式为GaAs;
(4)根据周期表对角线法则,金属Be和Al单质及化合物性质相似.试回答:
①写出Be和氢氧化钠反应的离子方程式Be+2OH-=BeO22-+H2↑.
②BeCl2溶液和MgCl2溶液可以用试剂NaOH溶液鉴别.
分析 由元素在周期表中的位置可知①~⑧分别为H、N、O、F、Na、Mg、Al、Cl,
(1)非金属性最强的为F,原子核外有2个电子层,最外层电子数为7;
(2)元素的金属性越强,对应的最高价氧化物的碱性越强;
(3)①介于金属和非金属分界线的元素可用于做半导体材料;
②Ga和As的化合价分别为+3价、-3价,以此判断化学式;
(4)①金属Be和Al单质及化合物性质相似,Be和氢氧化钠反应生成BeO22-和氢气;
②BeCl2溶液与氢氧化钠溶液反应,先生成沉淀,后溶解.
解答 解:由元素在周期表中的位置可知①~⑧分别为H、N、O、F、Na、Mg、Al、Cl,
(1)非金属性最强的为F,原子核外有2个电子层,最外层电子数为7,则原子结构示意图为 ,故答案为:F;
,故答案为:F; ;
;
(2)金属性Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的碱性越强,应为NaOH>Mg(OH)2>Al(OH)3,故答案为:NaOH>Mg(OH)2>Al(OH)3;
(3)①介于金属和非金属分界线的元素可用于做半导体材料,题中Si、Ge符合,故答案为:C;
②Ga和As的化合价分别为+3价、-3价,形成的化合物为GaAs,故答案为:GaAs;
(4)①金属Be和Al单质及化合物性质相似,Be和氢氧化钠反应生成BeO22-和氢气,离子方程式为Be+2OH-=BeO22-+H2↑,故答案为:Be+2OH-=BeO22-+H2↑;
②BeCl2溶液和MgCl2溶液可以用氢氧化钠溶液鉴别,BeCl2先生成沉淀,后溶解,故答案为:NaOH溶液.
点评 本题考查元素周期表与元素周期律应用,侧重对元素周期律的考查,有利于基础知识的巩固,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.在标准状况下进行甲、乙、丙三组实验.各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体.有关数据记录如表:
试回答:
(1)盐酸一定过量的是(填序号)甲,盐酸一定不足量的是乙和丙;
(2)要计算合金中镁的质量分数,所提供的数据中作计算依据的是甲,镁在合金中的质量分数为53.3%;
(3)在丙组实验之后,向容器中加入1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子
刚好沉淀完全,则溶液中偏铝酸钠的物质的量为0.009mol,所加入的苛性钠溶液的体积为39mL.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量g | 0.255 | 0.385 | 0.459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(1)盐酸一定过量的是(填序号)甲,盐酸一定不足量的是乙和丙;
(2)要计算合金中镁的质量分数,所提供的数据中作计算依据的是甲,镁在合金中的质量分数为53.3%;
(3)在丙组实验之后,向容器中加入1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子
刚好沉淀完全,则溶液中偏铝酸钠的物质的量为0.009mol,所加入的苛性钠溶液的体积为39mL.
17.下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
(1)表中化学性质最不活泼的元素是Ar,最活泼的金属元素是K,最活泼的非金属元素是F.
(2)表中能形成两性氧化物的元素是Al,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)③⑥⑦三种元素原子半径由大到小的顺序是S>Cl>F.
(4)用电子式表示由元素⑨⑦形成化合物的过程:K++ →
→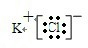 .
.
(5)③元素与⑩元素两者核电荷数之差是26.
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)表中能形成两性氧化物的元素是Al,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)③⑥⑦三种元素原子半径由大到小的顺序是S>Cl>F.
(4)用电子式表示由元素⑨⑦形成化合物的过程:K++
 →
→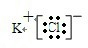 .
.(5)③元素与⑩元素两者核电荷数之差是26.
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.
| 实验步骤 | 实验现象与结论 |
18.下列有关说法不正确的是( )
| A. | 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(NH4+)减小 | |
| B. | 相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 | |
| C. | 工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 | |
| D. | 在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
19.萜品醇可作为消毒剂、抗氧化剂和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )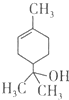

| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C9H16O |

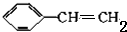 .
.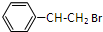 ;
;
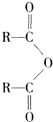 $\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
$\stackrel{H_{2}O}{→}$2RCOOH ②RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH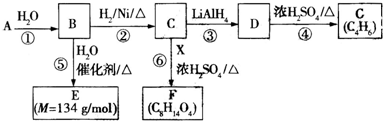
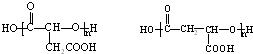 (一种即可).
(一种即可).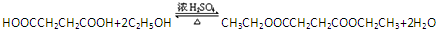 .
. .Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式:
.Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: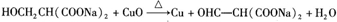 .
.