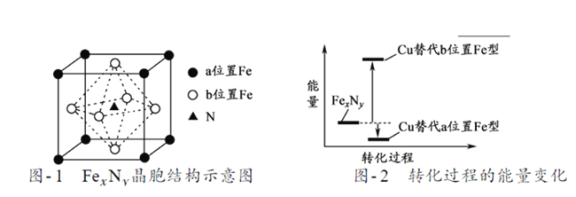
��Ŀ����
����Ŀ��������һ�ּ��߷�չDZ���������Դ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ������ͼ��ʾ��
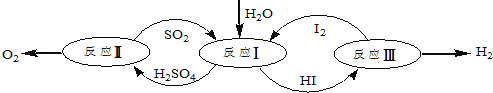
��1����ӦI�Ļ�ѧ����ʽ��____________________��
��2����ӦI�õ��IJ�����I2���з��룮�ò������Һ�ڹ���I2�Ĵ����»�ֳ����㣭����Ũ��I2��H2SO4��ͺ���Ũ��I2��HI�㡣
�ٸ���������ʵ������˵����ȷ����__________��ѡ����ţ���
a��������Һ���ܶȴ��ڲ���
b����I2ǰ��H2SO4��Һ��HI��Һ������
c��I2��HI��Һ�б���H2SO4��Һ������
�ڱ��������Һ�ķ�����_______________________________��
�۾���⣬H2SO4����c��H+����c��SO42����=2.06��1�����ֵ����2��ԭ����____________��
���𰸡�SO2+2H2O+I2=H2SO4+2HI ac �۲���ɫ����ɫ���ΪHI�㣬��ɫdz��Ϊ����� ������к�������HI����HI����������ӣ�
��������
��1����ͼ��֪����ӦIΪ����������ⷢ��������ԭ��Ӧ���������HI���÷�ӦΪSO2+2H2O+I2=H2SO4+2HI��
��2����a��������Һ���ܶȴ��ڲ�ų������²㣬��a��ȷ��
b����I2ǰ��H2SO4��Һ��HI��Һ���ܣ���ֲ��أ���b����
c��I2��HI��Һ�б���H2SO4��Һ�����ܣ�����ڲ�ͬ�ܼ����ܽ��Բ�ͬ��������ȡ����ֲ��йأ���c��ȷ����ѡac��
�ڱ��������Һ�ķ����ǹ۲���ɫ����ɫ���ΪHI�㣬��ɫdz��Ϊ����㣻
��H2SO4����c��H+����c��SO42����=2.06��1�����ֵ����2��ԭ����������к�������HI����HI����������ӡ�

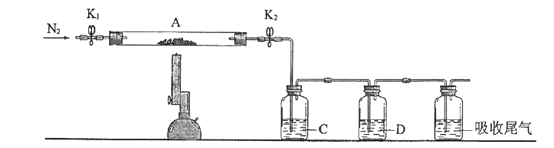
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���Ȼ���ͭ�������л��ϳɹ�ҵ�еĴ�����Ϊ��ɫ���壬�������Ҵ�������ˮ�� ������Ũ�����γ�������ӣ�[CuCl2]�������ܳ�¶�ÿ�����Ѹ�������ɼ�ʽ�Ρ�ʵ���� �� ���������Ʊ���
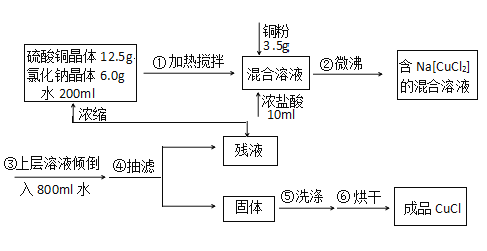
ע��Na[CuCl2](���룬��Һ��ɫ)ˮNaCl+CuCl��(��ɫ����)����ش�
��1��д��ʵ������ȡNa[CuCl2]�����ӷ���ʽ_____________��
��2���жϲ���ڷ�Ӧ��ȫ��������_______________��
��3��������йس��˲���������˵����ȷ����_________��
A. ѡ�������Ҫ��Ϊ�˼ӿ�����ٶȣ��õ��ϸ���ij���
B. ������ƿ�ͳ�����֮��Ӧ����һ����ȫƿ������ƿӦ�밲ȫƿ�ij��������
C. ����ʱ���˹��˽�״����������������ֽ���γ�һ����ʵ�ij���
D. ϴ�ӳ���ʱ��Ӧ��Сˮ��ͷ��ʹϴ�Ӽ�����ͨ��������
��4����������Ҵ���ˮ��Һϴ�ӵ�Ŀ����______________��
��5��������������ո������н��У���ԭ����___________________��
��6���Ȼ���ͭ�Ķ���
��ȡ��Ʒ0.25g��10ml������FeCl3��Һ��250ml��ƿ�У�����ܽ⡣
����0.10mol��L��1��������[Ce(SO4)2]����Һ�ζ���
��֪��CuCl+FeCl3=CuCl2+FeCl2�� Fe2++Ce4+=Fe3++Ce3+
����ƽ�����������£�ƽ�����������ܳ���1%����
ƽ��������� | 1 | 2 | 3 |
0.25g��Ʒ�������������Һ�������ml�� | 24.35 | 24.05 | 23.95 |
����Ʒ��CuCl�Ĵ���Ϊ____________�������������λ��Ч���֣�
����Ŀ����������������Ԫ��X��Y��Z��Q�����ڱ��е�λ����ͼ��ʾ��X��Y��W������������֮����Qԭ�Ӻ�����������ȡ�����˵���в���ȷ���ǣ�������
X | Y | ||
Z | Q | ||
W |
A. ���Ӱ뾶![]() ��r(Wm-)>r(Qm-)>r(Zn-)
��r(Wm-)>r(Qm-)>r(Zn-)
B. Ԫ��Z��Y�Ļ��ϼ۶����ܴ���![]() ��
��
C. �����Ʋ�HWO4��W������������ˮ����
D. XԪ�ص��⻯������࣬��������WԪ�صĵ��ʷ�����Ӧ
����Ŀ��Cr��S��Ԫ�صĻ����ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ�����Ӱ�졣
��1����ԭ�������Ǵ���������Cr2O72��CrO42����ҵ��ˮ�ij��÷������������£�
![]()
����֪�������£���ʼŨ��Ϊ1.0 mol��L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯��ͼ��ʾ��������������CrO42-ת��ΪCr2O72-�����ӷ���ʽΪ______________________��

����ԭ�������������뻹ԭ�������ʵ���֮��Ϊ__________��
��Cr3+��Al3+�Ļ�ѧ�������ƣ���CrCl3��Һ���ɲ����գ����յõ��Ĺ���Ļ�ѧʽΪ____________��
�������£�Ksp[Cr(OH)3]=1.0��10-32����ʹ�������ˮ�е�c(Cr3+)����1.0��10-5mol��L1����������ȫ����Ӧ��������Һ��pH=_____��
��2�����������η����������е�SO2
��������ͨ��1.0mol/L ��Na2SO3��Һ����Na2SO3ǡ����ȫ��Ӧʱ����ҺpHԼΪ3����ʱ����Һ�и�������Ũ���ɴ�С��˳��Ϊ_________��������Ũ�ȷ��ź��������ű�ʾ����
�������£����̵���ͨ��(NH4)2SO3��Һ�У������ҺpH�뺬��������ʵ��������ı仯��ϵ��ͼ��ʾ��

��֪����������ʵĵ��볣����25�棩���£�
����� | ���볣�� |
H2SO3 | Ka1=1.54��10-2 Ka2=1.02��10-7 |
NH3��H2O | Kb=1.74��10-5 |
��i��(NH4)2SO3��Һ��____�����������������������������ԣ���ԭ����_________________��
��ii��ͼ��b��ʱ��ҺpH=7����n(NH4+):n(HSO3- )=_________��