题目内容
【题目】氯化亚铜常用作有机合成工业中的催化剂,为白色晶体,不溶于乙醇,微溶于水, 易溶于浓盐酸形成络合离子([CuCl2]-)。受潮露置空气中迅速氧化成碱式盐。实验室 用 下列流程制备:
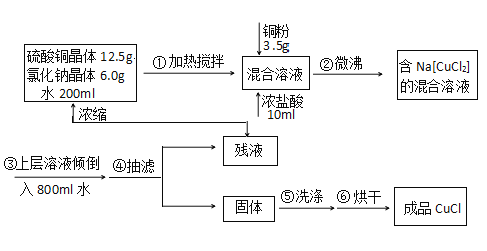
注:Na[CuCl2](易电离,溶液无色)水NaCl+CuCl↓(白色沉淀)。请回答:
(1)写出实验室制取Na[CuCl2]的离子方程式_____________。
(2)判断步骤②反应完全的现象是_______________。
(3)步骤④有关抽滤操作,下列说法正确的是_________。
A. 选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B. 在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C. 抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D. 洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(4)步骤⑤用乙醇的水溶液洗涤的目的是______________。
(5)步骤⑥烘干须在真空干燥箱中进行,其原因是___________________。
(6)氯化亚铜的定量
①取样品0.25g和10ml过量的FeCl3溶液于250ml锥形瓶中,充分溶解。
②用0.10mol·L-1硫酸锶铈[Ce(SO4)2]标准溶液滴定。
已知:CuCl+FeCl3=CuCl2+FeCl2; Fe2++Ce4+=Fe3++Ce3+
三次平行试验结果如下(平行试验结果相差不能超过1%):
平行试验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为____________。(结果保留三位有效数字)
【答案】Cu2++4Cl-+Cu=2[CuCl2]- 反应溶液由蓝色转变为无色透明为止 AD 洗去晶体表面的水和其它杂质 氯化亚铜在潮湿空气中能迅速氧化成碱式盐而变质 95.5%
【解析】
(1)实验室利用硫酸铜、浓盐酸和铜反应制取Na[CuCl2],反应的离子方程式为Cu2++4Cl-+Cu=2[CuCl2]-;
(2)铜离子为蓝色,Na[CuCl2]为无色,如果步骤②反应完全,则溶液中不存在铜离子的颜色,所以判断反应完全的现象是反应溶液由蓝色转变为无色透明为止;
(3)A. 颗粒太小的沉淀易在滤纸上形成一层密实的沉淀,溶液不易透过,则选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀,选项A正确;
B. 在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的短导管相接,否则易使水进入安全瓶,选项B错误;
C. 胶状沉淀易透过滤纸而不宜采用抽滤方法,选项C错误;
D. 在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失,选项D正确。
答案选AD;
(4)由于氯化亚铜不溶于乙醇,微溶于水,所以需用乙醇的水溶液进行洗涤,洗去晶体表面的液体杂质,故步骤⑤用乙醇的水溶液洗涤的目的是:洗去晶体表面的水和其它杂质;
(5)根据题中信息“受潮露置空气中迅速氧化成碱式盐”可知烘干须在真空干燥箱中进行,其原因是氯化亚铜在潮湿空气中能迅速氧化成碱式盐而变质。故步骤⑥烘干须在真空干燥箱中进行,其原因是:氯化亚铜在潮湿空气中能迅速氧化成碱式盐而变质;
(6)根据题目中所给数据及平行实验结果相差不能超过1%,故舍弃第一次数据,利用第二次和第三次数据计算,滴定0.25g样品消耗硫酸铈标准溶液的平均体积是![]() =24.0mL,所以CuCl的纯度为
=24.0mL,所以CuCl的纯度为![]() ×100%=95.5%。
×100%=95.5%。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案