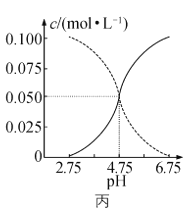
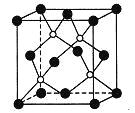
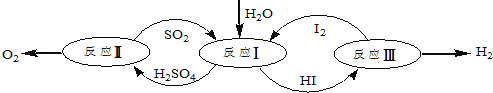
题目内容
【题目】某十钒酸铵[(NH4)xH6-xV10O28·yH2O(其中钒为+5价)]常用来制造高端钒铝合金。
Ⅰ. (NH4)xH6-xV10O28·yH2O的制备
将NH4VO3溶于pH为4的弱酸性介质后,加入乙醇,过滤得到(NH4)xH6-xV10O28·yH2O晶体。乙醇的作用是____________________________________。
Ⅱ. (NH4)xH6-xV10O28·yH2O的组成测定
(1) NH4+含量测定
准确称取0.363 6 g该十钒酸铵晶体,加入蒸馏水和NaOH溶液,加热煮沸,生成的氨气用20.00 mL 0.100 0 mol·L-1盐酸标准溶液吸收。用等浓度的NaOH标准溶液滴定过量盐酸,消耗NaOH标准溶液8.00 mL。
(2) V10O![]() (M=958 g·mol-1)含量测定
(M=958 g·mol-1)含量测定
步骤1:准确称取0.3636 g该十钒酸铵晶体,加入适量稀硫酸,微热使之溶解。
步骤2:加入蒸馏水和NaHSO3,充分搅拌,使V10O![]() 完全转化为VO2+。
完全转化为VO2+。
步骤3:加适量稀硫酸酸化,加热煮沸,除去溶液中+4价硫。
步骤4:用0.020 00 mol·L-1 KMnO4标准溶液滴定,终点时消耗30.00 mL KMnO4标准溶液(该过程中钒被氧化至+5价,锰被还原至+2价)。
①写出步骤2反应的离子方程式:____________________________________。
②若未进行步骤3操作,则数值y将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该十钒酸铵晶体的化学式(写出计算过程)。________
【答案】促进十钒酸铵晶体的析出 5HSO3-+V10O![]() +21H+=10VO2++5SO42-+13H2O 偏小 n(NH4+)=
+21H+=10VO2++5SO42-+13H2O 偏小 n(NH4+)=![]() =1.2×10-3 mol,n(V10O
=1.2×10-3 mol,n(V10O![]() )=
)=![]() =3.0×10-4 mol,x=
=3.0×10-4 mol,x=![]() =4,n(H2O)=
=4,n(H2O)=![]() =3.0×10-3 mol,y=
=3.0×10-3 mol,y=![]() =10,该十钒酸铵晶体的化学式为(NH4)4H2V10O28·10H2O。
=10,该十钒酸铵晶体的化学式为(NH4)4H2V10O28·10H2O。
【解析】
Ⅰ.(NH4)xH6-xV10O28·yH2O在乙醇中的溶解度较小;
Ⅱ. ①根据氧化还原反应原理分析;
②若未进行步骤3操作,则溶液中+4价硫与KMnO4能发生氧化还原反应,使消耗的KMnO4的体积偏大,V10O286-物质的量偏大, y将偏小;
③实验I中,n(NH3)=n(HCl)-n(NaOH),实验II中发生的反应:V10O286-+5HSO3-+21H+=10VO2++5SO42-+13H2O,5VO2++MnO4-+H2O=Mn2++5VO2++2H+,则V10O286-~10VO2+~2MnO4-,根据高锰酸钾的物质的量求出V10O286-的物质的量,利用物质的量之比等于微粒数目比求出x,再根据质量守恒定律求出水的质量和n的值。
Ⅰ.(NH4)xH6-xV10O28·yH2O在乙醇中的溶解度较小,乙醇的作用是促进十钒酸铵晶体的析出;
Ⅱ. ①步骤2:加入蒸馏水和NaHSO3,充分搅拌,使V10O![]() 完全转化为VO2+,HSO3-被氧化为SO42-,根据氧化还原反应原理进行配平,则反应的离子方程式为:5HSO3-+V10O
完全转化为VO2+,HSO3-被氧化为SO42-,根据氧化还原反应原理进行配平,则反应的离子方程式为:5HSO3-+V10O![]() +21H+=10VO2++5SO42-+13H2O;
+21H+=10VO2++5SO42-+13H2O;
②若未进行步骤3操作,则溶液中+4价硫与KMnO4能发生氧化还原反应,使消耗的KMnO4的体积偏大,根据方程式计算得到的V10O286-物质的量偏大,步骤4中的数值y将偏小;
③实验I中,n(NH3)=n(HCl)-n(NaOH),实验II中发生的反应:V10O286-+5HSO3-+21H+=10VO2++5SO42-+13H2O,5VO2++MnO4-+H2O=Mn2++5VO2++2H+,则V10O286-~10VO2+~2MnO4-,n(NH4+)=![]() =1.2×10-3 ol,n(V10O
=1.2×10-3 ol,n(V10O![]() )=
)=![]() =3.0×10-4 mol,x=
=3.0×10-4 mol,x=![]() =4,n(H2O)=
=4,n(H2O)=![]() =3.0×10-3 mol,y=
=3.0×10-3 mol,y=![]() =10,该十钒酸铵晶体的化学式为(NH4)4H2V10O28·10H2O。
=10,该十钒酸铵晶体的化学式为(NH4)4H2V10O28·10H2O。

 阅读快车系列答案
阅读快车系列答案【题目】二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)CH3OH(g)△H1=-91kJmol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=-24kJmol-1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=-41kJmol-1
回答下列问题:
(1)写出新工艺的总反应的热化学方程式:______
(2)某温度下在2L恒容密闭容器中加入CH3OH发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.42 | 0.22 | 0.02 | 0.02 |
①反应在2min内以CH3OCH3表示的化学反应速率为______
②该温度下的反应的平衡常数为______
(3)一定条件下的密闭容器中,在总反应达到平衡前,要使在单位时间内提高CO的转化率,可以采取的措施是______
A 增大压强 B 加入催化剂C 减少CO2的浓度 D 降低体系温度
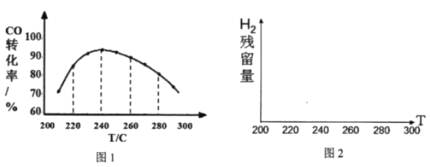
(4)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果CO转化率随温度变化的规律如图1,试解释原因:______
(5)该研究者还测定了相同条件下氢气的残留量,请在图2中划出H2的残留量随温度变化的曲线______