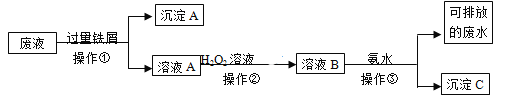
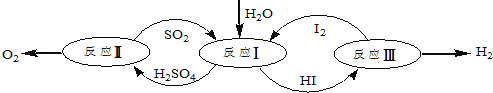
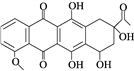
题目内容
【题目】常温下,用0.100molL-1NaOH溶液滴定25.00 mL 0.100molL-1H2C2O4溶液,所得滴定曲线如图所示(混合溶液的体积可看成混合前溶液的体积之和)。下列说法不正确的是( )

A. X 点所示溶液中:c(Na+)>c(HC2O4-)>c(C2O42-)
B. 观察Y点所示溶液,说明HC2O4-的电离程度大于C2O42-的水解程度
C. Z 点所示溶液中:c(Na+)>c(C2O42-))>c(HC2O4-)>c(OH-)>c(H+)
D. 整个滴定过程中:c(Na+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100molL-1
【答案】C
【解析】
A.酸碱浓度相等,酸是二元酸、碱是一元碱,X点溶液中溶质为NaHC2O4,溶液呈酸性,说明HC2O4电离程度大于水解程度,但是其电离和水解程度都较小,所以存在c(Na+)>c(HC2O4-)>c(C2O42-),故A正确;
B.Y点溶液中溶质为NaHC2O4和Na2C2O4,如果二者物质的量相等时,应该V(NaOH)为37.5mL,则Y点溶质浓度:NaHC2O4<Na2C2O4,混合溶液呈酸性,说明HC2O4-的电离程度大于C2O42-的水解程度c(HC2O4-)<c(OH-),故B正确;
C.Z点溶液中溶质为Na2C2O4,C2O42-只有一步水解生成HC2O4-,两步水解都生成OH-,所以存在,故C错误;
D.任何电解质溶液中都存在物料守恒,酸碱浓度相等,二者混合时根据物料守恒得c(Na+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100molL-1,故D正确;
故选:C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目