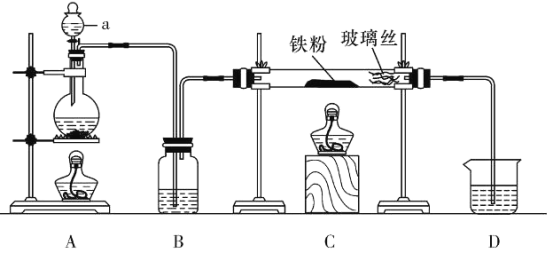
题目内容
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+第M层的电子排布式为_______________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为___________________(用元素符号表示),苯酚中碳原子的杂化轨道类型为____________。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为___________________(用元素符号表示),苯酚中碳原子的杂化轨道类型为____________。
(3)FeSO4常作补铁剂,SO42-的立体构型是_______________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含_______molσ键,与CO互为等电子体的离子是________(填化学式,写一种)。
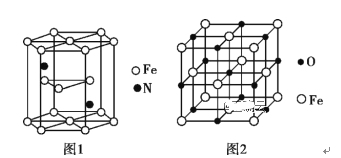
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2-的最短核间距为_____________ pm。
【答案】3s23p63d5 N>O>S sp2杂化 正四面体形 10 CN- 3∶1 12 ![]() ×1010
×1010
【解析】
根据原子或离子的核外电子排布规律分析解答;根据等电子体的概念分析解答;
(1) Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子和3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5 ,则M层电子排布式为:3s23p63d5;
故答案为:3s23p63d5;
(2) 根据同周期同主族元素性质递变规律判断,由于同一周期由左向右元素原子的第一电离能呈递增趋势,但氮原子2p轨道为半充满状态,第一电离能比相邻的元素都大,又由于同主族由上到下元素原子的第一电离能逐渐减小,N、O、S三种元素的第一电离能从大到小的顺序为N>O>S;苯环中的C形成3个σ键,无孤电子对,所以苯酚中碳原子的杂化轨道类型为sp2杂化;
故答案为:N>O>S,sp2杂化;
(3) SO42-中S原子价层电子对=4+![]() (6+2-4×2)=4,且不含孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
(6+2-4×2)=4,且不含孤电子对,所以其立体构型是正四面体,硫原子采取sp3杂化;
故答案为:正四面体;
(4) Fe和CO形成配位键,成键原子间只能形成一个σ键,因此1molFe(CO)5分子中含有10molσ键;等电子体是指价电子数和原子数相同的分子、离子或原子团。与CO互为等电子体的离子可能是CN-,故答案为:10 ,CN-;
(5)观察图一晶胞可以发现该晶胞中Fe原子个数为:(6+6)×![]() +2×
+2×![]() +3=6,N原子数为2,故该晶体中铁、氮的微粒个数之比为6:2=3:1;
+3=6,N原子数为2,故该晶体中铁、氮的微粒个数之比为6:2=3:1;
故答案为:3:1;
(6)从晶胞结构中可知,在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为12个,1个晶胞中含有Fe2+个数为:6×![]() +8×
+8×![]() 含有O2-个数为:12×
含有O2-个数为:12×![]() +1
+1![]() 原子Fe2+与O2-的最短核间距是
原子Fe2+与O2-的最短核间距是![]() 晶胞单元的棱长,设氧化亚铁的晶胞的
晶胞单元的棱长,设氧化亚铁的晶胞的![]() 单元棱长为apm,可得到等量关系:ρ×a3=
单元棱长为apm,可得到等量关系:ρ×a3=![]() ,可得到a=
,可得到a=![]() ×1010pm。
×1010pm。
故答案为:12 , ![]() ×1010。
×1010。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】某学习小组为了探究BrO3-+5Br-+6H+![]() 3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号 离子浓度 | ① | ② | ③ | ④ | ⑤ |
c(H+)/mol·L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/mol·L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/mol·L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v/mol·L-1·s-1 | 2.4×10-8 | 4.8×0-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论正确的是
A. 反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度完全相同
B. 实验②、④,探究的是c(BrO3-)对反应速率的影响
C. 若该反应速率方程为v=kca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=1
D. 实验⑤中,v1=4.8×10-8