题目内容
【题目】请根据要求书写出方程式。
(1)NO2与水形成酸雨的化学方程式为______________________________。
(2)1754年,Briestly用硵砂(主要成份NH4Cl)和熟石灰共热制得了氨,化学反应方程式为______________________________。
(3)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程_________________________________。
(4)可利用CH4等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH4与NO反应的化学方程式_________________________________。
【答案】3NO2+H2O=2HNO3+NO 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 2NO+2CO
CaCl2+2NH3↑+2H2O 2NO+2CO![]() N2+2CO2 CH4+4NO=CO2+2H2O+2N2
N2+2CO2 CH4+4NO=CO2+2H2O+2N2
【解析】
(1)NO2与水生成硝酸和一氧化氮;
(2) NH4Cl和氢氧化钙在加热条件下反应生成氨气、氯化钙和水;
(3)在催化剂存在下,NO和CO反应生成氮气和二氧化碳;
(4)CH4与NO反应生成氮气、二氧化碳和水。
(1)NO2与水生成硝酸和一氧化氮,化学方程式为:3NO2+H2O=2HNO3+NO;
(2)NH4Cl和氢氧化钙在加热条件下反应生成氨气、氯化钙和水,化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)在催化剂存在下,NO和CO反应生成氮气和二氧化碳,化学方程式为:2NO+2CO![]() N2+2CO2;
N2+2CO2;
(4)CH4与NO反应生成氮气、二氧化碳和水,化学方程式为:CH4+4NO=CO2+2H2O+2N2。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
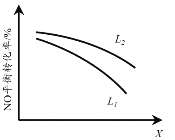
②L、X可分别代表压强或温度。下图表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______。
II.柴油燃油车是通过尿素-选择性催化还原(Urea-SCR)法处理氮氧化物。
Urea-SCR的工作原理为:尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生 NH3,生成的NH3与富氧尾气混合后,加入适合的催化剂,使氮氧化物得以处理。
(3)尿素水解的化学方程式是______。
(4)下图为在不同投料比[n(尿素)/n(NO)]时NO转化效率随温度变化的曲线。
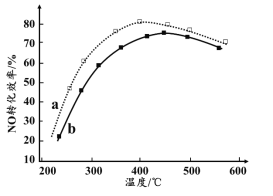
① 尿素与NO物质的量比a______b(填“>”、“=”或“<”)
② 由图可知,温度升高,NO转化效率升高,原因是______。温度过高,NO转化效率下降,NO的浓度反而升高,可能的原因是______(写出一种即可)。