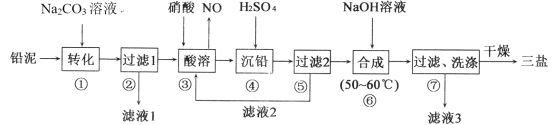
题目内容
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是__,还原性I-__NO(填“>”或“<”)。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有__(填序号)。
(3)请配平以下化学方程式:__Al+__NaNO3+__NaOH=__NaAlO2+__N2↑+_H2O
若反应过程中转移5mol电子,则生成标准状况下N2的体积为__L。
【答案】![]() > ②⑤ 10 6 4 10 3 2 11.2
> ②⑤ 10 6 4 10 3 2 11.2
【解析】
亚硝酸钠中的氮元素是+3价的,因此具有一定的氧化性,可以将![]() 氧化为
氧化为![]() ,同时自己被还原为+2价的
,同时自己被还原为+2价的![]() ,据此来分析本题即可。
,据此来分析本题即可。
(1)氧化剂得电子化合价降低,因此氧化剂为![]() ,而还原剂的还原性大于还原产物,因此有还原性
,而还原剂的还原性大于还原产物,因此有还原性![]() ;
;
(2)根据题干给出的反应,我们可以用碘化钾-淀粉试纸来鉴别亚硝酸钠,需要注意的是这个反应要在酸性条件下进行,因此我们还需要一瓶食醋,答案选②⑤;
(3)铝在反应中被氧化,失去3个电子,而硝酸钠在反应中被还原,得到5个电子,因此配平后的方程式为![]() ;该反应中每生成3mol氮气,需要转移30个电子,因此若反应过程中转移5mol电子,则一共生成0.5mol氮气,这些氮气在标况下的体积为
;该反应中每生成3mol氮气,需要转移30个电子,因此若反应过程中转移5mol电子,则一共生成0.5mol氮气,这些氮气在标况下的体积为![]() 。
。

【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
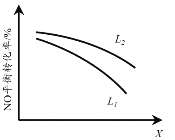
②L、X可分别代表压强或温度。下图表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______。
II.柴油燃油车是通过尿素-选择性催化还原(Urea-SCR)法处理氮氧化物。
Urea-SCR的工作原理为:尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生 NH3,生成的NH3与富氧尾气混合后,加入适合的催化剂,使氮氧化物得以处理。
(3)尿素水解的化学方程式是______。
(4)下图为在不同投料比[n(尿素)/n(NO)]时NO转化效率随温度变化的曲线。
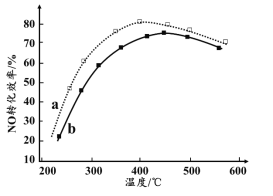
① 尿素与NO物质的量比a______b(填“>”、“=”或“<”)
② 由图可知,温度升高,NO转化效率升高,原因是______。温度过高,NO转化效率下降,NO的浓度反而升高,可能的原因是______(写出一种即可)。