题目内容
14.下列电子式中正确的是( )①氧原子
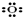 ②过氧根离子
②过氧根离子 ③氢氧根离子
③氢氧根离子 ④钠离子[Na]+
④钠离子[Na]+⑤氢离子H+⑥铵根离子
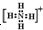 ⑦铝原子
⑦铝原子 ⑧溴负离子
⑧溴负离子
| A. | ①②③⑥⑦ | B. | ③④⑥⑦⑧ | C. | ③⑤⑥⑦⑧ | D. | ②③④⑦⑧ |
分析 简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷;无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷;离子化合物电子式的书写,是将阴阳离子(阳离子在前,阴离子在后.)拼在一起.
解答 解:①氧原子最外层为6个电子,氧原子的电子式为: ,故①错误;
,故①错误;
②过氧根离子为带有2个单位负电荷的离子,离子中存在一个O-O共价键,过氧根离子正确的电子式为: ,故②错误;
,故②错误;
③氢氧根离子为带有1个单位负电荷的阴离子,需要标出离子中各原子最外层电子,氢氧根离子的电子式为: ,故③正确;
,故③正确;
④钠离子为简单阳离子,直接用其离子符号表示其电子式,不需要用中括号,正确的电子式为Na+,故④错误;
⑤氢离子为简单阳离子,其电子式直接用离子符号表示,氢离子的电子式为:H+,故⑤正确;
⑥铵根离子为复杂阳离子,电子式中需要标出各原子的最外层电子,铵根离子的电子式为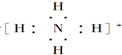 ,故⑥正确;
,故⑥正确;
⑦铝原子最外层为3个电子,铝原子的电子式为 ,故⑦正确;
,故⑦正确;
⑧溴离子为阴离子,电子式中需要标出最外层电子,溴离子的电子式为: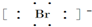 ,故⑧正确;故选C.
,故⑧正确;故选C.
点评 本题考查常见化学用语的正误判断,题目难度中等,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.CoCl2•6H2O是制备钴酸锂电池用四氧化三钴粉末的主要原料,工业上利用水钴矿(主要成分为Co2O3、Fe2O3、FeO、Al2O3等)制取CoCl2•6H2O的简化工艺流程如图所示:

(1)步骤1中三价钴转变为二价钴的离子反应方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)步骤2中加入的NaClO3目的是将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子.
(3)部分金属阳离子以氢氧化物形式沉淀时的pH情况如下:
步骤3中加入Na2CO3目的是除去铁和铝元素,其之所以可以除去铁和铝元素的原因是CO32-与H+反应消耗H+,促使Fe3+、Al3+水解平衡右移,生成Fe(OH)3、Al(OH)3沉淀而将其除去.理论上,此步pH应该控制的范围是5.4≤PH<7.6.
(4)操作1包括以下基本实验操作,它们是蒸发浓缩、冷却结晶和过滤、洗涤、风干.
(5)已知:Ag++SCN-=AgSCN↓,为测定粗品中CoCl2•6H2O的含量,称取11.9克粗品溶于水配成100mL溶液,从中取出25.00mL,先加入含AgNO30.03mol的溶液(杂质不反应),过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,该滴定所用指示剂为Fe(NO3)3;若消耗KSCN溶液20.00mL则该粗品中CoCl2•6H2O的质量含量为80%.

(1)步骤1中三价钴转变为二价钴的离子反应方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)步骤2中加入的NaClO3目的是将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子.
(3)部分金属阳离子以氢氧化物形式沉淀时的pH情况如下:
| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 开始沉淀的pH | 2.2 | 4.1 | 7.5 | 7.6 |
| 沉淀完全的pH | 3.5 | 5.4 | 9.5 | 9.2 |
(4)操作1包括以下基本实验操作,它们是蒸发浓缩、冷却结晶和过滤、洗涤、风干.
(5)已知:Ag++SCN-=AgSCN↓,为测定粗品中CoCl2•6H2O的含量,称取11.9克粗品溶于水配成100mL溶液,从中取出25.00mL,先加入含AgNO30.03mol的溶液(杂质不反应),过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,该滴定所用指示剂为Fe(NO3)3;若消耗KSCN溶液20.00mL则该粗品中CoCl2•6H2O的质量含量为80%.
5.下列有关化学反应表达正确的是( )
| A. | 服用阿司匹林过量出现水杨酸(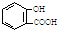 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: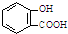 +2HCO3-→ +2HCO3-→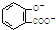 +2 CO2↑+2 H2O +2 CO2↑+2 H2O | |
| B. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
2.向硝酸钠溶液中加入铜粉不发生反应,若再加入某种盐,则铜粉可以逐渐溶解,符合此条件的盐是( )
| A. | ZnSO4 | B. | NaHCO3 | C. | NaHSO4 | D. | Fe(NO3)2 |
19.下列各组气体通常条件下能稳定共存( )
| A. | NH3 O2 HCl | B. | H2S O2 SO2 | C. | CO2 HI Cl2 | D. | N2 H2 HCl |
4.下表给出14-17号元素的一些性质,请回答:
(1)它们所形成的氢化物中稳定性最差的是SiH4,还原性最差的是HCl.
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强,试从原子结构的角度加以解释四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强.
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由.能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2 反应的条件 | 高温 | 磷蒸气与 H2能反应 | 加热 | 光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 | H4SiO4 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 最强含氧酸 |
(2)四种元素的非金属性随着元素原子序数的递增而逐渐增强,试从原子结构的角度加以解释四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强.
(3)一定条件下,反应H2S+Cl2=2HCl+S能否发生?简述理由.能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.