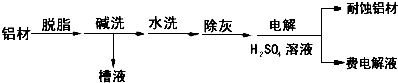
题目内容
9.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
(1)“粉碎”的目的是增大接触面积,加快反应速率;提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).
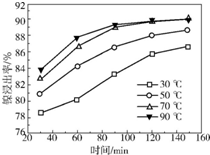
a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不再产生沉淀,则“沉镍”工序已经完成.将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得18.3kg草酸镍晶体(Ni:59,C:12,H:1,O:16).
分析 (1)把废镍催化剂粉碎,增大了反应的接触面积,加快反应速率,提高镍的浸出率;
(2)根据镍浸出率随时间变化图可知,70℃时,镍浸出率很大,从时间看,120min镍浸出率就已经很高了;
(3)“沉镍”工序中,可以用继续滴加(NH4)2C2O4溶液的方法,检验Ni2+是否沉淀完全,待溶液静置后,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;“沉镍”工序生成了(NH4)2SO4,用乙醇洗涤,能洗去(NH4)2SO4杂质、便于烘干;
(4)为了除去铁、铝元素,取“浸出液”,用双氧水氧化二价铁为三价铁,再加入NaOH溶液,调节溶液5.0≤pH≤6.7,让Al3+、Fe3+沉淀完全,不能让Ni2+沉淀;根据Ksp(CaF2)=1.46×10-10<Ksp(CaC2O4)=2.34×10-9,加入适量NH4F溶液,生成CaF2,除去Ca2+;
(5)草酸镍晶体(NiC2O4•2H2O)在320℃分解得到Ni、CO2和H2O;
(6)根据关系式:Ni~NiC2O4•2H2O计算.
解答 解:(1)把废镍催化剂粉碎,增大了反应的接触面积,加快反应速率,提高镍的浸出率,
故答案为:增大接触面积,加快反应速率,提高镍的浸出率;
(2)根据镍浸出率随时间变化图可知,70℃时,镍浸出率很大,从时间看,120min镍浸出率就已经很高了,
故答案为:c;
(3)“沉镍”工序中,可以用继续滴加(NH4)2C2O4溶液的方法,检验Ni2+是否沉淀完全,待溶液静置后,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;“沉镍”工序生成了(NH4)2SO4,用乙醇洗涤,能洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失,
故答案为:静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失;
(4)为了除去铁、铝元素,用双氧水氧化二价铁为三价铁,再加入NaOH溶液,调节溶液5.0≤pH≤6.7,让Al3+、Fe3+沉淀完全,不能让Ni2+沉淀;根据Ksp(CaF2)=1.46×10-10<Ksp(CaC2O4)=2.34×10-9,加入适量NH4F溶液,生成CaF2,除去Ca2+,
故答案为:5.0≤pH<6.7;除去杂质Ca2+;
(5)草酸镍晶体(NiC2O4•2H2O)在320℃分解得到Ni、CO2和H2O,反应的方程式为NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O;
故答案为:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O;
(6)根据关系式:Ni~NiC2O4•2H2O
59 183
100kg×5.9% m,
解得m=18.3kg;
故答案为:18.3.
点评 本题考查了物质分离的实验设计和方法应用,主要是利用溶液不同pH条件下离子沉淀的情况不同,控制溶液PH除去杂质离子,得到较纯净的硫酸镍溶液来制备硫酸镍晶体,同时考查了除杂原则不能引入新的杂质,题目难度大

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 能使pH试纸显蓝色的溶液中:K+、Ba2+、H+、Br- | |
| B. | 加入Al能放出H2的溶液中:K+、Na+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| D. | 能使石蕊试液显红色的溶液中:K+、SO42-、S2-、CO32- |
| A. | H2>O2>CO>CO2 | B. | H2>CO>O2>CO2 | C. | CO2>O2>CO>H2 | D. | CO2>H2>O2>CO |
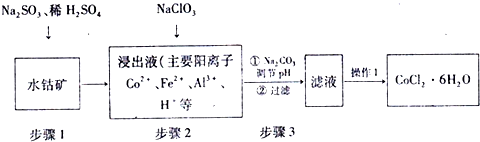
(1)步骤1中三价钴转变为二价钴的离子反应方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)步骤2中加入的NaClO3目的是将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子.
(3)部分金属阳离子以氢氧化物形式沉淀时的pH情况如下:
| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 开始沉淀的pH | 2.2 | 4.1 | 7.5 | 7.6 |
| 沉淀完全的pH | 3.5 | 5.4 | 9.5 | 9.2 |
(4)操作1包括以下基本实验操作,它们是蒸发浓缩、冷却结晶和过滤、洗涤、风干.
(5)已知:Ag++SCN-=AgSCN↓,为测定粗品中CoCl2•6H2O的含量,称取11.9克粗品溶于水配成100mL溶液,从中取出25.00mL,先加入含AgNO30.03mol的溶液(杂质不反应),过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,该滴定所用指示剂为Fe(NO3)3;若消耗KSCN溶液20.00mL则该粗品中CoCl2•6H2O的质量含量为80%.
亚硫酸钠法:Na2SO3+S+5H2O=Na2S2O3•5H2O,简易实验流程如下:

(1)硫粉用乙醇润湿的目的是有利于硫粉与亚硫酸钠溶液充分接触,加快反应速率.
(2)操作中不能将溶液蒸发至干的原因是蒸干会使硫代硫酸钠晶体脱水并分解.
(3)所得粗产品一般通过重结晶方法提纯.
硫化碱法:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下:
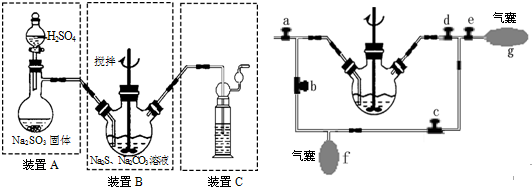
(4)装置C的作用是吸收反应生成的CO2和多余的SO2,防止污染大气.
(5)为充分利用SO2,对装置B进行改进(如上右图所示):当A中反应发生后,关闭旋塞b、e,打开a、c、d,往B中溶液通入SO2,未反应的SO2被收集到气囊f中.待f收集到较多气体时(假定此时装置A中反应已停止),关闭旋塞ac,打开旋塞bde,轻轻挤压f,使SO2缓缓地压入B中溶液再次反应,未反应的SO2又被收集在气囊g中.再将g中的气体挤压入f中,如此反复,直至完全反应.
(6)为测定硫代硫酸钠晶体粗产品的纯度.某兴趣小组称取5.0克粗产品配成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点.实验数据如下表:
| 滴定次数 | 1 | 2 | 3 |
| 消耗Na2S2O3溶液(mL) | 19.98 | 21.18 | 20.02 |
②可能造成实验结果偏低的有BD(填编号).
A.锥形瓶用蒸馏水润洗
B.滴定管未用Na2S2O3溶液润洗
C.滴定终点时俯视读数
D.若滴定前滴定管尖嘴处有气泡,滴定后消失.
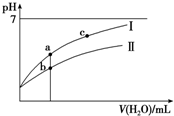 已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
| A. | ${\;}_{8}^{18}$O2-离子结构示意图: | B. | NH4Cl的电子式: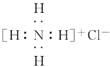 | ||
| C. | 含78个中子的碘的核素:53131I | D. | 二氧化硅的分子式:SiO2 |
| A. | NH3 O2 HCl | B. | H2S O2 SO2 | C. | CO2 HI Cl2 | D. | N2 H2 HCl |