题目内容
7.某溶液中含有Ag+、Cu2+、Ba2+和NO3-,现用盐酸、NaOH溶液和Na2SO4溶液将溶液中三种阳离子逐一沉淀分离,其流程如图所示.下列说法不正确的是( )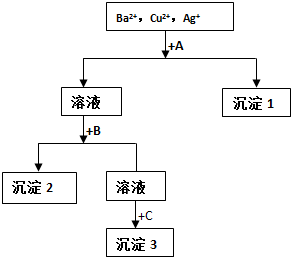
| A. | 试剂A只能为盐酸溶液 | |
| B. | 沉淀2可能是BaSO4 也可能是Cu(OH)2 | |
| C. | 每加一种试剂需过量且要过滤后方可进行下一步 | |
| D. | 生成沉淀1的离子方程式可能为:Cu2++2OH-=Cu(OH)2↓ |
分析 某溶液中含有Ag+、Cu2+、Ba2+和NO3-,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,氢氧根离子和铜离子、银离子反应,硫酸根离子和钡离子反应,所以先用盐酸将银离子转化为沉淀,则A是盐酸;
过滤后加入Na2SO4或NaOH生成硫酸钡沉淀或Cu(OH)2沉淀,所以B可能是硫酸钠或NaOH,据此进行判断.
解答 解:某溶液中含有Ag+、Cu2+、Ba2+和NO3-,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,氢氧根离子和铜离子、银离子反应,硫酸根离子和钡离子反应,所以先用盐酸将银离子转化为沉淀,则A是盐酸;过滤后加入Na2SO4或NaOH生成硫酸钡沉淀或Cu(OH)2沉淀,所以B可能是硫酸钠或NaOH,
A.通过以上分析知,A是盐酸,故A正确;
B.根据分析可知,沉淀2可能是BaSO4 也可能是Cu(OH)2,故B正确;
C.除杂时,为了除尽杂质离子,所加入的除杂试剂必须过量,由于实验目的是将三种阳离子逐一沉淀分离,所以每步过滤后方可进行下一步,故C正确;
D.沉淀1为氯化银,则生成沉淀1的离子方程式为:Ag++Cl-=AgCl↓,故D错误;
故选D.
点评 本题考查了离子检验和除杂,题目难度中等,明确离子检验方法是解本题关键,注意根据离子的性质来分析解答,难点是除杂剂的选取方法.

练习册系列答案
相关题目
15.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:NH3>PH3>SiH4 | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 熔点:Al>Mg | D. | 电负性:F>N>O>C |
2.某烃含碳、氢元素的质量比为6:l,对氮气的相对密度为2,该烃既可使溴水褪色,又能与氢气加成,与氢气加成的产物的二氯化物有3种同分异构体,则该烃为( )
| A. | CH2═CH2 | B. | CH2═CH-CH2CH3 | C. | 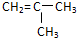 | D. | CH2═CH-CH═CH2 |
12. 已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
(1)写出该反应的平衡常数表达式K=$\frac{c(CO{\;}_{2})}{c(CO)}$.
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断:
①升高温度,混合气体的平均相对分子质量减小(填“增大、减小或不变”);
②充入氦气,平衡不移动(填“正向移动”、“逆向移动”或“不移动”);
③充入CO2并重新平衡后,混合气体的密度增大(填“增大、减小或不变”).
(3)该反应的逆反应速率随时间变化情况如图所示.
①从如图可知,在t1时改变了某种反应条件,使平衡发生移动,反应在t2时达到平衡,改变的条件可能是a(选填编号).
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在图画出t3~t5时间段的v逆变化曲线.
③下列不能作为判断该反应达到平衡状态的依据是b(选填编号).
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体质量不再变化 d.混合气体中碳元素的质量分数不再变化.
 已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断:
①升高温度,混合气体的平均相对分子质量减小(填“增大、减小或不变”);
②充入氦气,平衡不移动(填“正向移动”、“逆向移动”或“不移动”);
③充入CO2并重新平衡后,混合气体的密度增大(填“增大、减小或不变”).
(3)该反应的逆反应速率随时间变化情况如图所示.
①从如图可知,在t1时改变了某种反应条件,使平衡发生移动,反应在t2时达到平衡,改变的条件可能是a(选填编号).
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在图画出t3~t5时间段的v逆变化曲线.
③下列不能作为判断该反应达到平衡状态的依据是b(选填编号).
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体质量不再变化 d.混合气体中碳元素的质量分数不再变化.
19.将Na单质的性质与Fe单质的性质放在一起进行研究,分析其异同点,这种研究方法是( )
| A. | 观察法 | B. | 实验法 | C. | 分类法 | D. | 比较法 |
16.元素的性质随着元素原子序数的递增而呈周期性变化的根本原因是( )
| A. | 元素原子的核外电子排布的周期性变化 | |
| B. | 元素的相对原子质量逐渐增大 | |
| C. | 元素化合价的周期性变化 | |
| D. | 元素原子的核外电子层数的逐渐增多 |
 当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答:
当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答: