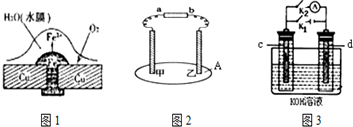
题目内容
12. 已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:
已知可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g),其温度与平衡常数K的关系如表:| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断:
①升高温度,混合气体的平均相对分子质量减小(填“增大、减小或不变”);
②充入氦气,平衡不移动(填“正向移动”、“逆向移动”或“不移动”);
③充入CO2并重新平衡后,混合气体的密度增大(填“增大、减小或不变”).
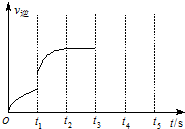
(3)该反应的逆反应速率随时间变化情况如图所示.
①从如图可知,在t1时改变了某种反应条件,使平衡发生移动,反应在t2时达到平衡,改变的条件可能是a(选填编号).
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在图画出t3~t5时间段的v逆变化曲线.
③下列不能作为判断该反应达到平衡状态的依据是b(选填编号).
a.v正(CO2)=v逆(CO) b.容器内气体总压强不再变化
c.容器内气体质量不再变化 d.混合气体中碳元素的质量分数不再变化.
分析 (1)根据反应方程式FeO(s)+CO(g)?Fe(s)+CO2(g)书写K的表达式;
(2)①根据表中数据可知,升高温度,K减小,说明平衡逆移,由二氧化碳转变成一氧化碳;
②充入氦气,反应物生成物浓度不变,则平衡不移动;
③充入CO2并重新平衡后,虽然平衡逆向移动,但气体质量仍然增大,体积不变,所以密度增大;
(3)①根据影响化学反应速率的因素来确定改变的条件;
②增加CO2的量,会促使平衡正向移动,正逆反应速率都要加快,据此回答;
③化学平衡标志是正逆反应速率相同,各组分含量保持不变,各组分的浓度不随着时间的改变而改变,据此分析选项.
解答 解:(1)①根据反应方程式FeO(s)+CO(g)?Fe(s)+CO2(g)书写K,表达式为K=$\frac{c(CO{\;}_{2})}{c(CO)}$,故答案为:K=$\frac{c(CO{\;}_{2})}{c(CO)}$;
(2)①根据表中数据可知,升高温度,K减小,说明平衡逆移,由二氧化碳转变成一氧化碳,所以混合气体的平均相对分子质量减小,故答案为:减小;
②充入氦气,反应物生成物浓度不变,则平衡不移动,故答案为:不移动;
③充入CO2并重新平衡后,虽然平衡逆向移动,但气体质量仍然增大,体积不变,所以密度增大,故答案为:增大;
(3)①从如图可知,在t1时改变了某种反应条件,反应在t2时达到平衡,改变的条件使速率变化离开原速率点了,应该是同时能让正逆反应速率加快的条件并且向正反应方向移动,故答案为:a;
②在t3时增加CO2的量,会使得正逆反应速率都加快,逆反应速率在原来的基础上逐渐加快,图为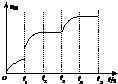 ,故答案为:
,故答案为: ;
;
③a.v正(CO2)=v逆(CO),说明正逆反应速率相等,则能说明达到平衡,故错误;
b.因为反应前后气体体积不变,所以容器内气体总压强不再变化,不能说明达到平衡,故正确;
c.容器内气体质量不再变化是平衡状态的特征,故错误;
d.混合气体中碳元素的质量分数不再变化,说明一氧化碳和二氧化碳组成固定,则能说明达到平衡,故错误;
故答案为:b.
点评 本题考查学生化学平衡状态的判断、平衡常熟的意义以及影响化学反应速率的因素等知识,注意知识的归纳和梳理是解题的关键,难度中等.

| A. | CO2 | B. | 氯水 | C. | 水蒸气 | D. | 氯化钠溶液 |
| A. | 用100mL量筒取5.0mL稀硫酸 | |
| B. | 用托盘天平称取2.50gNaCl固体 | |
| C. | 读数时,视线与溶液的凹液面最低点相切 | |
| D. | 在250mL容量瓶中配制240mL0.1mol/LNaOH溶液 |
| A. | 标准状况下22.4L CH4 | B. | 28g N2( N2的摩尔质量为28g/mol ) | ||
| C. | 1.5mol H2O | D. | 6.02×1023个NH3 |
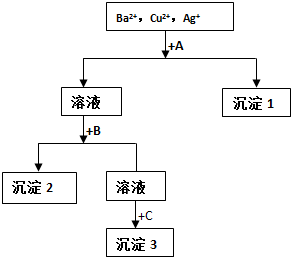
| A. | 试剂A只能为盐酸溶液 | |
| B. | 沉淀2可能是BaSO4 也可能是Cu(OH)2 | |
| C. | 每加一种试剂需过量且要过滤后方可进行下一步 | |
| D. | 生成沉淀1的离子方程式可能为:Cu2++2OH-=Cu(OH)2↓ |
| A. | 阳极:Cu-2e-═Cu2+ 阴极:Cu2++2e-═Cu | |
| B. | 阳极:2Cu+2I--2e-═2CuI 阴极:2H++2e-═H2↑ | |
| C. | 阳极:2I--2e-═I2 阴极:2H++2e-═H2↑ | |
| D. | 阳极:4OH--4e-═2H2O+O2↑ 阴极:4H++4e-═2H2↑ |
| A. | 纯棉布 | B. | 尼龙 | C. | 汽车轮胎 | D. | 晴纶 |
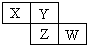 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | Y的氢化物只有一种 |