题目内容
17.用0.1mol/L的盐酸标准溶液滴定未知浓度的NaOH溶液,观察酸式滴定管读数时,若滴定前仰视,滴定后俯视,其结果会导致测得NaOH溶液的浓度( )| A. | 偏高 | B. | 偏低 | C. | 准确 | D. | 无法判断 |
分析 滴定管读数时,滴定前仰视读数,读数偏大,滴定后俯视读数,读数偏小.
解答 解:滴定管读数时,滴定前仰视读数,滴定后俯视读数,造成V(酸)偏小,可知c(NaOH)偏低.
故选B.
点评 本题考查了中和滴定中的误差分析,注意无论哪一种类型的误差,都可以归结为对标准溶液体积的影响,其标准溶液的体积偏小,物质的量的浓度也偏小;其标准溶液的体积偏大,物质的量的浓度也偏大,本题难度不大.

练习册系列答案
相关题目
7.连二亚硫酸钠(Na2S2O4),是印刷工业中重要的还原剂.某小组进行如下实验:
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】
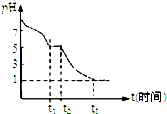
(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
(3)资料显示:保险粉、H2O2均可用于纸浆漂白.写出保险粉与过量的H2O2,在水溶液中反应生成硫酸盐等物质的离子方程式:S2O42-+3H2O2=2SO42-+2H++2H2O_.
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】

(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
8.常温下,在10mL 0.2mol/L氨水中,滴入0.2mol/L的稀盐酸,使溶液的pH=7.则下列说法正确的是( )
| A. | 加入盐酸的体积大于10 mL | B. | c(NH4+)=c(Cl-) | ||
| C. | 加入盐酸的体积等于10 mL | D. | c(NH4+)<c(Cl-) |
5.在一定条件下,pH相同的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-amol.L-1 和1.0×10-bmol.L-1,在此温度下,下列说法正确的( )
| A. | a<b | B. | a=b | ||
| C. | 水的离子积为1.0×10-(7+a) | D. | 水的离子积为1.0×10-(b+a) |
12.据报道,中国科技大学研制出的以NaOH溶液为电解液的锌空气燃料电池具有零污染、高能量,及材料可再生等优点.该电池的总反应为2Zn+O2+4NaOH═2Na2ZnO2+2H2O.下列说法中正确的是( )
| A. | 电池工作时,电子通过外电路从正极流向负极 | |
| B. | 负极的电极反应式为Zn+4OH--2e-═ZnO22-+2H2O | |
| C. | 该电池每消耗65 g Zn吸收11.2 LO2 | |
| D. | 在电池工作过程中,电解液的pH增大 |
2.下列物质能使红墨水褪色的是( )
| A. | CO2 | B. | 氯水 | C. | 水蒸气 | D. | 氯化钠溶液 |
9.下面关于催化剂的说法正确的是( )
| A. | 催化剂只改变反应的正反应速率 | |
| B. | 催化剂通过升高反应的活化能来加快反应速率 | |
| C. | 催化剂能够改变反应的反应热 | |
| D. | 催化剂不能改变反应物的转化率 |
7.某溶液中含有Ag+、Cu2+、Ba2+和NO3-,现用盐酸、NaOH溶液和Na2SO4溶液将溶液中三种阳离子逐一沉淀分离,其流程如图所示.下列说法不正确的是( )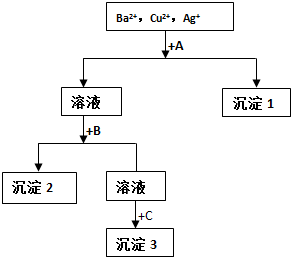

| A. | 试剂A只能为盐酸溶液 | |
| B. | 沉淀2可能是BaSO4 也可能是Cu(OH)2 | |
| C. | 每加一种试剂需过量且要过滤后方可进行下一步 | |
| D. | 生成沉淀1的离子方程式可能为:Cu2++2OH-=Cu(OH)2↓ |