题目内容
15.下列有关物质性质的比较顺序中,不正确的是( )| A. | 热稳定性:NH3>PH3>SiH4 | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 熔点:Al>Mg | D. | 电负性:F>N>O>C |
分析 A、非金属性越强氢化物的稳定性越强,同主族自上而下元素的非金属性减弱;
B、电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
C、金属元素的金属性越强,其熔点越低;
D、得电子能力越强,电负性越大.
解答 解:A、同主族自上而下元素的非金属性减弱,从左到右增强,非金属性N>P>Si,所以氢化物稳定性NH3>PH3>SiH4,故A正确;
B、电子层结构相同核电荷数越大离子半径越小,故离子半径Na+>Mg2+,最外层电子数相同电子层越多离子半径越大,所以微粒半径K+>Na+,故微粒半径K+>Na+>Mg2+>Al3+,故B正确;
C、由于金属性Mg>Al,故熔点Al>Mg,故C正确;
D、得电子能力F>O>N>C,所以电负性是:F>O>N>C,故D错误,故选D.
点评 本题考查微粒半径比较、同周期同主族元素的性质递变规律等,难度中等,注意掌握微粒半径大小比较规律与金属性、非金属性的比较.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
5.在一定条件下,pH相同的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-amol.L-1 和1.0×10-bmol.L-1,在此温度下,下列说法正确的( )
| A. | a<b | B. | a=b | ||
| C. | 水的离子积为1.0×10-(7+a) | D. | 水的离子积为1.0×10-(b+a) |
3.下列方法能达到实验要求的是( )
| A. | 用100mL量筒取5.0mL稀硫酸 | |
| B. | 用托盘天平称取2.50gNaCl固体 | |
| C. | 读数时,视线与溶液的凹液面最低点相切 | |
| D. | 在250mL容量瓶中配制240mL0.1mol/LNaOH溶液 |
20.下列物质所含分子数最多的是( )
| A. | 标准状况下22.4L CH4 | B. | 28g N2( N2的摩尔质量为28g/mol ) | ||
| C. | 1.5mol H2O | D. | 6.02×1023个NH3 |
7.某溶液中含有Ag+、Cu2+、Ba2+和NO3-,现用盐酸、NaOH溶液和Na2SO4溶液将溶液中三种阳离子逐一沉淀分离,其流程如图所示.下列说法不正确的是( )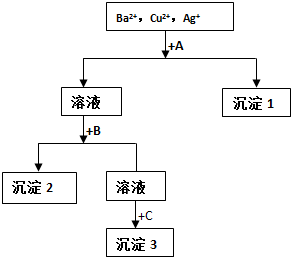

| A. | 试剂A只能为盐酸溶液 | |
| B. | 沉淀2可能是BaSO4 也可能是Cu(OH)2 | |
| C. | 每加一种试剂需过量且要过滤后方可进行下一步 | |
| D. | 生成沉淀1的离子方程式可能为:Cu2++2OH-=Cu(OH)2↓ |
5.下列解释实验事实的离子方程式不正确的是( )
| A. | 氧化铝与稀盐酸:Al2O3+6 H+═2 Al3++3H2O | |
| B. | 稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 用大理石与稀盐酸制备CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯气与氯化亚铁溶液:Cl2+Fe2+═2Cl-+Fe3+ |