题目内容
17. 当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答:
当前环境问题,如酸雨、温室效应、臭氧层破坏、光化学烟雾、有毒物质的污染等,已成为世界各国普遍关注和研究的问题.请回答:(1)汽车尾气中的有害气体包括②(填序号,下同).
①N2 ②NO2
(2)使臭氧层受到破坏的主要气体是②.
①二氧化碳②氟氯代烷
(3)造成居室污染的放射性物质是②.
①苯 ②氡
(4)如图所示的图标表示可回收垃圾的是①.
(5)下列污水中能引起水体富营养化的是①.
①含N、P的废水 ②含重金属离子的废水
(6)向含Hg2+的废水中加入Na2S以除去Hg2+,该反应的离子方程式为Hg2++S2-=HgS↓.
(7)煤燃烧时产生的SO2等污染物会对大气造成污染,向煤中加入适量的石灰石,可大大减少燃烧产物中SO2的量,该反应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2.
分析 (1)二氧化氮有毒,为汽车尾气成分之一;
(2)氟氯代烷能够破坏大气层中的臭氧层;
(3)苯无放射性,氡为放射性物质;
(4)金属可以回收再利用,属于可回收垃圾;
(5)含N、P为植物生成需要元素,能够促进植物生长;
(6)硫化钠中硫离子与汞离子反应生成硫化汞沉淀;
(7)碳酸钙与二氧化硫、氧气反应生成硫酸钙和二氧化碳.
解答 解:(1)汽车尾气中的有害气体含有氮气;
故答案为;②;
(2)使臭氧层受到破坏的主要气体是氟氯代烷;
故答案为:②;
(3)苯无放射性,氡为放射性物质,造成居室污染的放射性物质是氡;
故答案为:②;
(4)金属可以回收再利用,属于可回收垃圾;
故答案为:①;
(5)含N、P的废水能够引起水体富营养化;
故答案为:①;
(6)硫化钠中硫离子与汞离子反应生成硫化汞沉淀,离子方程式:Hg2++S2-=HgS↓;
故答案为:Hg2++S2-=HgS↓;
(7)碳酸钙与二氧化硫、氧气反应生成硫酸钙和二氧化碳,化学方程式:2CaCO3+2SO2+O2=2CaSO4+2CO2;
故答案为:2CaCO3+2SO2+O2=2CaSO4+2CO2;
点评 本题考查了生活中常见的环境污染与治理,明确物质的性质,熟悉常见污染物是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
7.某溶液中含有Ag+、Cu2+、Ba2+和NO3-,现用盐酸、NaOH溶液和Na2SO4溶液将溶液中三种阳离子逐一沉淀分离,其流程如图所示.下列说法不正确的是( )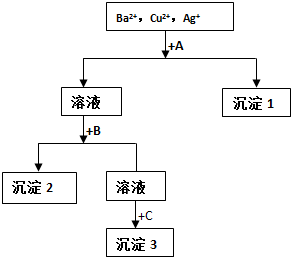

| A. | 试剂A只能为盐酸溶液 | |
| B. | 沉淀2可能是BaSO4 也可能是Cu(OH)2 | |
| C. | 每加一种试剂需过量且要过滤后方可进行下一步 | |
| D. | 生成沉淀1的离子方程式可能为:Cu2++2OH-=Cu(OH)2↓ |
8.下列说法正确的是( )
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的负极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被氧化 |
5.下列解释实验事实的离子方程式不正确的是( )
| A. | 氧化铝与稀盐酸:Al2O3+6 H+═2 Al3++3H2O | |
| B. | 稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 用大理石与稀盐酸制备CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯气与氯化亚铁溶液:Cl2+Fe2+═2Cl-+Fe3+ |
2.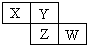 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | Y的氢化物只有一种 |
9.下列说法正确的是( )
| A. | 能够发生化学反应的碰撞是有效碰撞 | |
| B. | 活化分子之间的碰撞一定是有效碰撞 | |
| C. | 反应物分子的每次碰撞都能发生化学反应 | |
| D. | 增大反应物浓度时,活化分子百分数增大 |
7.短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12.回答下列问题:
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1mol气态氢化物对应的热量变化如下,其中能表示该主族第4周期元素的单质生成1mol气态氢化物所对应的热量变化是b(选填字母编号).
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.
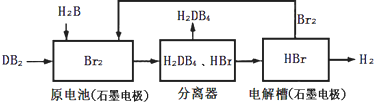
①查得:
试写出通常条件下电解槽中发生总反应的热化学方程式:2HBr(aq)=Br2(aq)+H2(g)△H=+94 kJ/mol
②根据资料:
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到无淡黄色沉淀出现,最终出现白色沉淀,证明分离效果较好.
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=SO42-+4H+.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点
有溴可以循环利用,获得清洁能源氢气(答一点即可);缺点有生成过程有有毒物质,电解循环能源消耗大(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-.
(4)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+Br2(g)△H=+105.4kJ/mol.在密闭容器中将过量CuBr2于487K下加热分解,平衡时P(Br2)为4.66×103 Pa.
①如反应体系的体积不变,提高反应温度,则p(Br2)将会增大(填“增大”“不变”“减小”).
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为2.33×103 Pa<p(Br2)≤4.66×103 Pa.
| A | B | |
| C | D |
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.

①查得:
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
②根据资料:
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=SO42-+4H+.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点
有溴可以循环利用,获得清洁能源氢气(答一点即可);缺点有生成过程有有毒物质,电解循环能源消耗大(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-.
(4)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+Br2(g)△H=+105.4kJ/mol.在密闭容器中将过量CuBr2于487K下加热分解,平衡时P(Br2)为4.66×103 Pa.
①如反应体系的体积不变,提高反应温度,则p(Br2)将会增大(填“增大”“不变”“减小”).
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为2.33×103 Pa<p(Br2)≤4.66×103 Pa.
8.下列关于S、SO2、H2SO4的叙述中,正确的是( )
| A. | 硫是一种易溶于水的黄色晶体 | |
| B. | SO2溶于水生成H2SO4 | |
| C. | 用氢氧化钠溶液处理含有SO2的尾气 | |
| D. | 浓H2SO4不稳定,光照易分解 |