题目内容
16.元素的性质随着元素原子序数的递增而呈周期性变化的根本原因是( )| A. | 元素原子的核外电子排布的周期性变化 | |
| B. | 元素的相对原子质量逐渐增大 | |
| C. | 元素化合价的周期性变化 | |
| D. | 元素原子的核外电子层数的逐渐增多 |
分析 元素的性质取决于元素价电子,元素原子的核外电子排布的周期性变化导致元素性质(金属性和非金属性,原子半径,化合价等)的周期性变化.
解答 解:原子结构决定元素的性质,则原子的核外电子排布尤其是最外层电子排布决定了元素的性质,所以元素的性质随着原子序数的递增呈周期性变化的原因是元素原子的核外电子排布的周期性变化,故选:A.
点评 本题考查元素周期律实质,明确结构决定性质、性质体现结构是解本题关键,知道元素价电子对元素性质的影响,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
7.某溶液中含有Ag+、Cu2+、Ba2+和NO3-,现用盐酸、NaOH溶液和Na2SO4溶液将溶液中三种阳离子逐一沉淀分离,其流程如图所示.下列说法不正确的是( )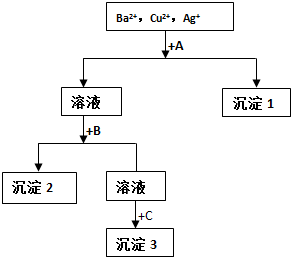

| A. | 试剂A只能为盐酸溶液 | |
| B. | 沉淀2可能是BaSO4 也可能是Cu(OH)2 | |
| C. | 每加一种试剂需过量且要过滤后方可进行下一步 | |
| D. | 生成沉淀1的离子方程式可能为:Cu2++2OH-=Cu(OH)2↓ |
11.对于锌、铜和稀硫酸组成的原电池,下列有关说法正确的是( )
| A. | Zn是正极 | B. | 电子由铜片经外电路流向锌片 | ||
| C. | Zn-2e-═Zn2+ | D. | 溶液中H+向锌片迁移 |
1.下列物质的主要成分不是纤维的是( )
| A. | 纯棉布 | B. | 尼龙 | C. | 汽车轮胎 | D. | 晴纶 |
8.下列说法正确的是( )
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的pH不同,引起的负极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被氧化 |
5.下列解释实验事实的离子方程式不正确的是( )
| A. | 氧化铝与稀盐酸:Al2O3+6 H+═2 Al3++3H2O | |
| B. | 稀H2SO4与BaCl2溶液反应生成沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 用大理石与稀盐酸制备CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯气与氯化亚铁溶液:Cl2+Fe2+═2Cl-+Fe3+ |
7.短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12.回答下列问题:
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1mol气态氢化物对应的热量变化如下,其中能表示该主族第4周期元素的单质生成1mol气态氢化物所对应的热量变化是b(选填字母编号).
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.
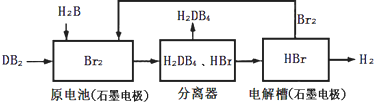
①查得:
试写出通常条件下电解槽中发生总反应的热化学方程式:2HBr(aq)=Br2(aq)+H2(g)△H=+94 kJ/mol
②根据资料:
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到无淡黄色沉淀出现,最终出现白色沉淀,证明分离效果较好.
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=SO42-+4H+.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点
有溴可以循环利用,获得清洁能源氢气(答一点即可);缺点有生成过程有有毒物质,电解循环能源消耗大(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-.
(4)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+Br2(g)△H=+105.4kJ/mol.在密闭容器中将过量CuBr2于487K下加热分解,平衡时P(Br2)为4.66×103 Pa.
①如反应体系的体积不变,提高反应温度,则p(Br2)将会增大(填“增大”“不变”“减小”).
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为2.33×103 Pa<p(Br2)≤4.66×103 Pa.
| A | B | |
| C | D |
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.

①查得:
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
②根据资料:
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=SO42-+4H+.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点
有溴可以循环利用,获得清洁能源氢气(答一点即可);缺点有生成过程有有毒物质,电解循环能源消耗大(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-.
(4)CuBr2分解的热化学方程式为:2CuBr2(s)=2CuBr(s)+Br2(g)△H=+105.4kJ/mol.在密闭容器中将过量CuBr2于487K下加热分解,平衡时P(Br2)为4.66×103 Pa.
①如反应体系的体积不变,提高反应温度,则p(Br2)将会增大(填“增大”“不变”“减小”).
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为2.33×103 Pa<p(Br2)≤4.66×103 Pa.