题目内容
9.现有部分短周期元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | K电子数比L层电子数少4个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
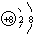 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式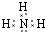 (用元素符号表示)
(用元素符号表示)(2)写出Y元素最高价氧化物对应水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由具有金属性.
分析 T单质能与水剧烈反应,所得溶液呈弱酸性,则T为F元素,X的K电子数比L层电子数少4个,核外电子排布为:1S22S22P4,为O元素;第三周期元素的简单离子中半径最小的离子为Al3+,则Y为Al元素;Z的L层有三个未成对电子,核外电子排布为1S22S22P3,为N元素,以此解答该题.
解答 解:T单质能与水剧烈反应,所得溶液呈弱酸性,则T为F元素,X的K电子数比L层电子数少4个,核外电子排布为:1S22S22P4,为O元素;第三周期元素的简单离子中半径最小的离子为Al3+,则Y为Al元素;Z的L层有三个未成对电子,核外电子排布为1S22S22P3,为N元素,
(1)X为O元素,离子核外最外层达到8电子稳定结构,结构示意图为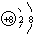 ,Z的氢化物为NH3,电子式为
,Z的氢化物为NH3,电子式为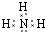 ,
,
故答案为: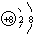 ;
;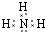 ;
;
(2)Y元素最高价氧化物水化物Al(OH)3,为两性氢氧化物,存在酸式电离和碱性电离两种电离,电离方程式为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(3)F的非金属性比Cl元素强,可根据得电子能力判断,氯与F形成的化合物中氯元素呈正价态,说明F易得到电子,则说明F的非金属性强,
故答案为:F;C;
(4)Al为金属元素,具有金属性,其它三种元素为非金属元素,具有较强的非金属性,
故答案为:Al;具有金属性.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律,明确原子结构与元素周期表、元素周期律的关系.

练习册系列答案
相关题目
20. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)常温下5% H2O2在FeCl3溶液的催化作用下发生反应的化学方程式为2H2O22H2O↑+O2↑.
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中).
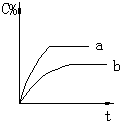
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
17.下列反应既是加成反应又可看作还原反应的是( )
| A. | 乙烯与水反应生成乙醇 | B. | 苯转化为环己烷 | ||
| C. | 乙醇转化为乙醛 | D. | 乙醛转化为乙酸 |
14.有机物A的键线式结构为  ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )| A. | 有机物A的一氯取代物只有4种 | |
| B. | 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷 | |
| C. | 有机物A的分子式为C8H18 | |
| D. | B的结构可能有3种,其中一种名称为3,4,4-三甲基-2-戊烯 |
18.已知A、B两元素的原子序数,其中可形成AB2型共价化合物的是( )
①6和16 ②12和17 ③20和9 ④7和8.
①6和16 ②12和17 ③20和9 ④7和8.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
19.下列说法正确的是( )
| A. | 乙烯使溴水或酸性高锰酸钾褪色均属于加成反应 | |
| B. | 用乙醇与浓硫酸加热至170℃制乙烯的反应属于取代反应 | |
| C. | 用“地沟油”生产生物柴油只发生酯化反应 | |
| D. | 用重铬酸钾溶液检验司机是否酒驾所发生的反应属于乙醇的氧化反应 |




 .
. ;该反应类型酯化反应
;该反应类型酯化反应