题目内容
1.气态反应A+B?C+D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反应过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的是( )| A. | 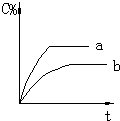 | B. | 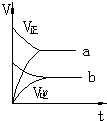 | C. | 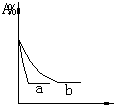 | D. | 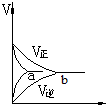 |
分析 气态反应A+B?C+D,有催化剂化学反应速率加快,但是达到平衡时A与B的转化率不变,A或B的体积分数或百分含量不变,据此解答即可.
解答 解:A、催化剂只改变化学反应速率,加入催化剂,化学反应速率加快,不会改变反应物和生成物的含量,故A错误;
B、a为加入催化剂,b为无催化剂,加入催化剂,正、逆化学反应速率均加快,故B正确;
C、加入催化剂,化学反应速率加快,但是A的百分含量不变,故C正确;
D、加入催化剂,正逆反应速率均加快,即a点对应的正反应速率和逆反应速率应大于b点对应正反应速率与逆反应速率,故D错误,故选AD.
点评 本题主要考查的是催化剂对化学反应速率的影响,加入催化剂只改变化学反应速率,不改变物质的转化率和百分含量,此点也是容易出错的地方,难度一般.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.(1)在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1所示.
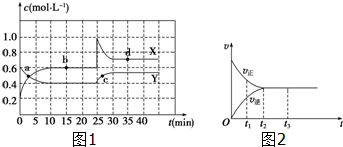
①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
根据以上数据回答问题:
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.

①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
| 时间(s) 物质的量(mol) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.01 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.
12.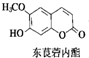 中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )
中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )
 中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )
中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )| A. | 分子式为C10H12O4 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 一定条件下,1 mol该物质最多可与3 mol Br2反应 | |
| D. | 一定条件下,1 mol该物质最多可与1 mol NaOH反应 |
9.现有部分短周期元素的性质或原子结构如下表:
(1)写出元素X的离子结构示意图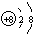 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式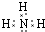 (用元素符号表示)
(用元素符号表示)
(2)写出Y元素最高价氧化物对应水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由具有金属性.
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | K电子数比L层电子数少4个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
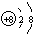 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式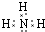 (用元素符号表示)
(用元素符号表示)(2)写出Y元素最高价氧化物对应水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由具有金属性.
6.某溶液中存在大量的H+、Cl-、Ba2+,该溶液中还可能大量存在的是( )
| A. | Al3+ | B. | S2- | C. | SO${\;}_{4}^{2-}$ | D. | HCO3- |
13.砷为第四周期ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
| A. | 砷在通常状况下是固体 | B. | 可以有-3、+3、+5等多种化合价 | ||
| C. | As2O5对应水化物的酸性比H3PO4弱 | D. | 砷的还原性比磷弱 |
10.“绿色化学”是指从技术、经济上设计可行的化学反应或化工设备,尽可能地节约能源,或尽可能减少对环境的负作用.下列选项中不符合绿色化学概念的是( )
| A. | 工业生产硫酸、硝酸的设备中安装热交换器 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 消除硫酸厂尾气中的SO2:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| D. | 用废铜屑制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O |
11.下列装置所示的实验中,能达到实验目的是( )
| A. | 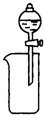 CCl4萃取I2后从下口放出水层 | B. | 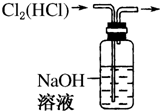 除去Cl2中的HCl | ||
| C. | 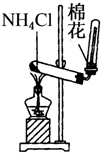 实验室制氨气 | D. |  排水法收集NO |
 .
.