题目内容
20.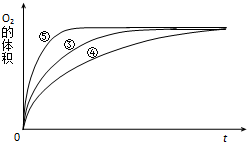 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析 (1)氯化铁为催化剂,双氧水在催化剂作用下分解生成水和氧气;
(2)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;
(3)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答.
解答 解:(1)常温下5% H2O2在FeCl3溶液的催化作用下发生反应生成水和氧气,反应的化学方程式为:2H2O2 $\frac{\underline{催化剂}}{△}$2H2O↑+O2↑,
故答案为:2H2O2 $\frac{\underline{催化剂}}{△}$2H2O↑+O2↑;
(2)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(3)由图可知,⑤的反应速率最大,④的反应速率最小,③的反应速率居中,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
点评 本题考查影响化学反应速率的因素,题目难度中等,试题侧重考查学生实验设计、数据处理、图象分析的综合能力,注意信息的利用即可解答.

练习册系列答案
相关题目
10.下列关于元素周期表的叙述,正确的是( )
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 每一周期的元素都是从碱金属开始,以稀有气体结束 | |
| C. | 最外层电子数为2的元素都位于第ⅡA族 | |
| D. | 在已经发现的元素中,金属元素种类比非金属元素多 |
11.(1)在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1所示.
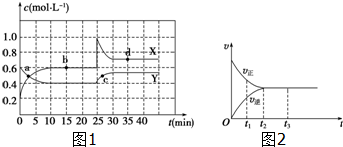
①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
根据以上数据回答问题:
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.

①该反应的化学方程式为(反应物或生成物用符号X、Y表示):Y?2X.
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.
(2)图2是可逆反应X2+3Y2?2Z在反应过程中的反应速率(v)与时间(t)的关系曲线.下列叙述正确的是bd.
a.t1时,只有正方向反应
b.t2时,反应达到限度
c.t2~t3,反应不再发生
d.t2~t3,各物质的浓度不再发生变化
(3)表中列出的是某温度和压强下,2L容器中,化学反应2SO2+O2?2SO3在不同时间点测得密闭体系中三种物质的物质的量
| 时间(s) 物质的量(mol) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.01 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
①计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075 mol•L-1•s-1 mol/(L•min)-1.
②反应70s后,其他条件不变,只改变一个条件,使反应速率增大.则该条件可能是(要求:写出3点即可)a.加入催化剂,b.升高温度,c.增大浓度.
8.如图是某有机物分子的比例模型,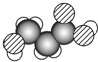 有关该物质的推断正确的是( )
有关该物质的推断正确的是( )
 有关该物质的推断正确的是( )
有关该物质的推断正确的是( )| A. | 分子中可能含有羟基 | B. | 分子中可能含有酯基 | ||
| C. | 分子中可能含有醛基 | D. | 该物质的分子式可能为C3H4O3 |
15.对某一可逆反应来说,使用催化剂的作用( )
| A. | 提高反应物的利用率 | B. | 改变平衡混合物的组成 | ||
| C. | 以同样程度改变正逆反应的速率 | D. | 增大正反应速率,减小逆反应速率 |
5.下列有关乙醇的性质的应用中正确的是( )
| A. | 由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 | |
| B. | 由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 | |
| C. | 乙醇能与乙酸在一定条件下反应生成乙酸乙酯和水,说明乙醇具有碱性 | |
| D. | 由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法 |
12.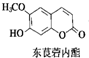 中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )
中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )
 中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )
中草药中常存在东莨菪内酯,属于香豆素类化合物,东莨菪内酯结构如图所示.下列东莨菪内酯的说法正确的是( )| A. | 分子式为C10H12O4 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 一定条件下,1 mol该物质最多可与3 mol Br2反应 | |
| D. | 一定条件下,1 mol该物质最多可与1 mol NaOH反应 |
9.现有部分短周期元素的性质或原子结构如下表:
(1)写出元素X的离子结构示意图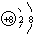 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式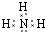 (用元素符号表示)
(用元素符号表示)
(2)写出Y元素最高价氧化物对应水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由具有金属性.
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | K电子数比L层电子数少4个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
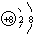 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式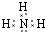 (用元素符号表示)
(用元素符号表示)(2)写出Y元素最高价氧化物对应水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-
(3)元素T与氯元素相比,非金属性较强的是F(用元素符号表示),下列表述中能证明这一事实的是C.
A.常温下氯气的颜色比T单质的颜色深
B.T的单质通入氯化钠水溶液不能置换出氯气
C.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是Al,理由具有金属性.
10.“绿色化学”是指从技术、经济上设计可行的化学反应或化工设备,尽可能地节约能源,或尽可能减少对环境的负作用.下列选项中不符合绿色化学概念的是( )
| A. | 工业生产硫酸、硝酸的设备中安装热交换器 | |
| B. | 消除制硝酸工业尾气的氮氧化物污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| C. | 消除硫酸厂尾气中的SO2:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| D. | 用废铜屑制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O |